题目内容
18.下列排列顺序正确的是( )| A. | 原子半径:Al<Mg<F | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
分析 A.电子层越多,原子半径越大;同周期原子序数大的原子半径小;
B.非金属性越强,对应氢化物越稳定;
C.非金属性越强,对应最高价含氧酸的酸性越强;
D.金属性越强,对应最高价氧化物的水化物碱性越强.
解答 解:A.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则原子半径:F<Al<Mg,故A错误;
B.非金属性越强,对应氢化物越稳定,则热稳定性:HF>HCl>HBr>HI,故B错误;
C.非金属性越强,对应最高价含氧酸的酸性越强,则酸性:H2SiO3<H3PO4<H2SO4<HClO4,故C正确;
D.金属性越强,对应最高价氧化物的水化物碱性越强,则碱性:Al(OH)3<Mg(OH)2<NaOH,故D错误;
故选C.
点评 本题考查元素周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
13.元素周期表中的短周期元素X和Y,可组成化合物XY3,下列说法正确的是( )
| A. | XY3一定是离子化合物 | |
| B. | 若Y的原子序数为m,则X的原子序数一定为m±4 | |
| C. | X和Y可属于同一周期,也可属于不同周期 | |
| D. | X和Y一定不属于同一主族 |
3.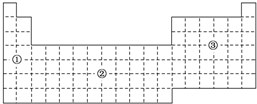 如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )
如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )
 如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )
如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )| A. | ①区、③区、③区 | B. | ①区、③区、②区 | C. | ①区、②区、②区 | D. | ②区、③区、③区 |
10.下列物质:①氯水 ②氯化氢气体 ③盐酸 ④熔融氯化钠 ⑤氯酸钾溶液 ⑥四氯化碳 其中不含氯离子的是( )
| A. | ①②③⑤ | B. | ①③④ | C. | ②⑤⑥ | D. | ①③④⑤ |
7.将元素周期表原先的主、副族族号取消,从左往右改为18列,碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是( )
| A. | 不仅有第2列元素的原子最外层有2个电子 | |
| B. | 第3~12列元素全为金属 | |
| C. | 第3列元素种类最多 | |
| D. | 第15、16、17列元素都是非金属元素 |
 ,加聚反应.
,加聚反应. +3HNO3(浓)$→_{△}^{浓硫酸}$
+3HNO3(浓)$→_{△}^{浓硫酸}$ +3H2O,取代反应.
+3H2O,取代反应.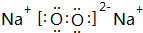
 .
. ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了构造原理、泡利原理和洪特规则.
,这样排布遵循了构造原理、泡利原理和洪特规则.
 ,G中化学键的类型为极性共价键;
,G中化学键的类型为极性共价键;