题目内容
7.将元素周期表原先的主、副族族号取消,从左往右改为18列,碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是( )| A. | 不仅有第2列元素的原子最外层有2个电子 | |
| B. | 第3~12列元素全为金属 | |
| C. | 第3列元素种类最多 | |
| D. | 第15、16、17列元素都是非金属元素 |
分析 A.He位于18列,最外层电子为2,且某些过渡元素的最外层电子数为2;
B.第3~12列为副族和第ⅤⅢ族;
C.第3列含镧系和锕系;
D.第15、16、17列元素都是由非金属元素和金属元素组成.
解答 解:A.He位于18列,最外层电子为2,且某些过渡元素的最外层电子数为2,则不仅有第2列元素的原子最外层有2个电子,故A正确;
B.第3~12列为副族和第ⅤⅢ族,均为金属元素,故B正确;
C.第3列含镧系和锕系,则含元素种类最多,故C正确;
D.第15、16、17列元素都是由非金属元素和金属元素组成,故D错误;
故选D.
点评 本题考查元素周期表的结构及应用,为高频考点,把握周期表的结构、元素的位置为解答的关键,侧重分析与应用能力的考查,注意各周期中元素种类及周期表中的8、9、10三个纵列为第ⅤⅢ族,题目难度不大.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
17.反应CH3OH(g)+NH3(g)═CH3NH2(g)+H2O(g)在高温下才能自发向右进行,则该反应的△H、△S应为( )
| A. | △H>0、△S<0 | B. | △H<0、△S>0 | C. | △H>0、△S>0 | D. | △H<0、△S<0 |
18.下列排列顺序正确的是( )
| A. | 原子半径:Al<Mg<F | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
15.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)G元素在周期表中的位置是第四周期第Ⅷ族.
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
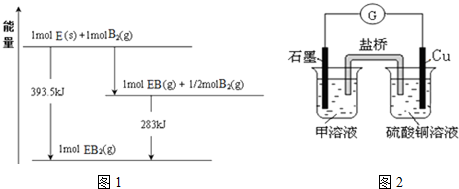
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
2.下列说法不正确的是( )
| A. | 甲基的电子式为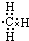 | |
| B. | 大量获得乙烯的工业方法是乙醇的消去反应 | |
| C. | C3H8只能表示一种物质 | |
| D. | 乙烷在光照的条件下与氯气混和,最多可以生成10种物质 |
12.下列叙述正确的是( )
| A. | 蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有性脱水性 | |
| B. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| C. | 将SO2通入BaCl2溶液能生成白色沉淀 | |
| D. | 可用澄清石灰水溶液鉴别 CO2和SO2 |
19.短周期主族元素X、Y、Z、W的原子序数依次递增,X的一种原子核内无中子,Y原子最外层电子数是内层电子总数的2倍,W原子最外层电子数是Y原子最外层电子数的1.5倍,Z、W同主族,下列说法正确的是( )
| A. | 含X与Y的化合物只有2种 | |
| B. | Y、W的氧化物均为酸性氧化物 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X与Z形成的化合物中,各原子均满足8电子稳定结构 |
16.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法不正确的是( )
| A. | CO2是氧化产物 | |
| B. | KClO3在反应中发生还原反应 | |
| C. | 生成5.6LCO2,转移的电子数目为0.25NA | |
| D. | 24.5g KClO3参加反应,转移电子物质的量为0.2mol |
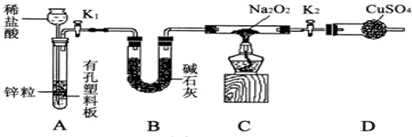 钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.
钠的化合物在工农业生产和人们的日常生活中有着广泛的应用,其中Na2O2常用作漂白剂和潜水艇中的供氧剂.Na2O2有强氧化性,H2具有还原性,某同学根据氧化还原反应的知识推测Na2O2与H2能反应.为了验证此推测结果,该同学设计并进行如下实验,实验步骤和现象如下.