题目内容
3.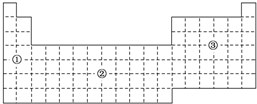 如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )
如果把元素周期表分为下面3个区域,则最活泼的金属、最活泼的非金属、最不活泼的非金属元素分别位于( )| A. | ①区、③区、③区 | B. | ①区、③区、②区 | C. | ①区、②区、②区 | D. | ②区、③区、③区 |
分析 最活泼的金属是碱金属位于s区、最活泼的非金属是元素周期表的右上角,位于p区,而最不活泼的非金属元素是稀有气体元素位于p区,由此分析解答.
解答 解:①是s区、②是ds区、③是p区,最活泼的金属是碱金属位于s区、最活泼的非金属是元素周期表的右上角,位于p区,而最不活泼的非金属元素是稀有气体元素位于p区,故选A.
点评 本题考查元素周期表的结构与应用,为高频考点,把握周期表的结构、元素性质与位置为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
14.下列关于资源及其利用的说法正确的是( )
| A. | 煤的干馏,石油的裂化和裂解均属于化学变化 | |
| B. | 利用铝热反应可以冶炼Fe、Cr、Mn、W、Na等金属 | |
| C. | 甲烷和氯气制备一氯甲烷的原子利用率可达100% | |
| D. | SO2、NO2、CO2均是导致酸雨的主要原因 |
18.下列排列顺序正确的是( )
| A. | 原子半径:Al<Mg<F | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
15.A、B、C、D、E、F是中学化学中常见的六种短周期元素,有关位置及信息如下:A的气态氢化物能使湿润的红色石蕊试纸变蓝;C单质在实验室一般保存在煤油中;F的最高价氧化物对应的水化物既能与酸反应又能与碱反应,G单质是日常生活中用量最大的金属,易被腐蚀.请回答下列问题:
(1)G元素在周期表中的位置是第四周期第Ⅷ族.
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.
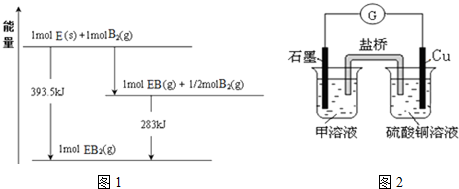
(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
| … | E | A | B | ||
| C | … | D |
(2)A与B可组成质量比为7:16的三原子分子,该分子与水反应的化学方程式:3NO2+H2O=2HNO3+NO;
(3)同温同压下,将a L A氢化物的气体和b L D的氢化物气体通入水中,若a=b,则所得溶液的pH<7(填“>“或“<”或“=”),若所得溶液的pH=7,则a>b(填“>“或“<”或“=”)
(4)写出F的单质与NaOH溶液反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)已知一定量的E单质能在B2 (g)中燃烧,其可能的产物及能量关系如图1所示:请写出一定条件下EB2(g) 与E(s)反应生成EB(g)的热化学方程式CO2(g)+C(s)=2CO(g)△H=+172.5kJ/mol.

(6)若在D与G组成的某种化合物的溶液甲中,加入铜片,溶液会慢慢变为蓝色,依据产生该现象的反应原理,所设计的原电池如图2所示,其反应中正极反应式为Fe3++e-=Fe2+.
12.下列叙述正确的是( )
| A. | 蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有性脱水性 | |
| B. | 硫粉在过量的氧气中燃烧可以生成SO3 | |
| C. | 将SO2通入BaCl2溶液能生成白色沉淀 | |
| D. | 可用澄清石灰水溶液鉴别 CO2和SO2 |
13.把足量的铁粉投入到硫酸与硫酸铜的混合溶液中,充分反应后,残余固体的质量与原来加入的铁粉的质量相等,则原溶液中H+和SO42-的物质的量之比为( )
| A. | 1:4 | B. | 2:7 | C. | 1:2 | D. | 8:3 |



