题目内容
8.氢气用于工业合成氨 N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ•mol-1.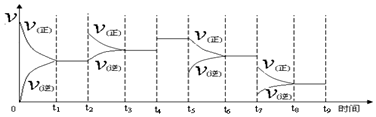
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如图所示,其中t4﹑t5﹑t7时刻对应的实验条件改变分别是
t4加入催化剂.
t5减小NH3浓度.
t7降温.
②温度为T℃时,将2nmolH2和nmolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50%,此时放出热量46.1kJ.则n=1.
分析 ①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如图所示,其中t4﹑t5﹑t7时刻对应的实验条件改变分别是t4正逆反应速率同时增大相同的倍数,所以使用催化剂;t5时平衡正向移动,但逆反应的速率突然减小,所以减小生成物的浓度;t7时刻正逆反应速率都减小,且反应向正反应方向进行,说明是降低温度;
②由反应方程式可知:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ•mol-1,1mol的氮气与3mol的氢气完全反应放出92.2Kj的热量,而此时放出热量46.1kJ,所以参加反应的氮气的物质的量为$\frac{46.1}{92.2}$=0.5mol,即n×50%=0.5mol.
解答 解:①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,正逆反应速率与时间的关系如图所示,其中t4﹑t5﹑t7时刻对应的实验条件改变分别是t4正逆反应速率同时增大相同的倍数,所以使用催化剂;t5时平衡正向移动,但逆反应的速率突然减小,所以减小生成物的浓度;t7时刻正逆反应速率都减小,且反应向正反应方向进行,说明是降低温度,平衡正向进行,
故答案为:t4 加入催化剂;t5 减小NH3浓度;t7 降温;
②由反应方程式可知:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ•mol-1,1mol的氮气与3mol的氢气完全反应放出92.2Kj的热量,而此时放出热量46.1kJ,所以参加反应的氮气的物质的量为$\frac{46.1}{92.2}$=0.5mol,即n×50%=0.5mol,解之得n=1mol,
故答案为:1.
点评 本题考查了化学反应热的计算,和图象的分析,化学平衡的移动及影响因素,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握反应的特征,结合图象的曲线变化解答该题.题目综合性强,较难.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案| A. | MgO、Al2O3熔点高,均可用作耐高温材料 | |
| B. | NH4HCO3受热易分解,可用作氮肥 | |
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| D. | SO2具有氧化性,可用于漂白纸浆 |
| A. | 丙醛 | B. | 丁醇 | C. | 葡萄糖 | D. | 乙酸乙酯 |
| A. | H2C=CH2+HCl→H3C-CH2Cl | |
| B. | 2CH3CH2OH+O2$\stackrel{催化剂}{→}$2CH3CHO+2H2O | |
| C. | 2C6H6+15O2 $\stackrel{点燃}{→}$12CO2+6H2O | |
| D. | CH3CH3+Cl2→CH3CH2Cl+HCl |
| A. | 把色彩鲜艳的着色剂添加到婴幼儿食品中 | |
| B. | 做菜时用适量的食盐、味精和醋调味 | |
| C. | 把发霉的大米晒干并淘洗干净后做成甜酒上市销售 | |
| D. | 把过期食品下架回收,重新喷码后再上架销售 |
| A. | CH3COOH溶液的导电能力比相同浓度的HCl溶液小 | |
| B. | 在25℃时,0.1mol/L的CH3COOH溶液pH约为3 | |
| C. | 在25℃时,1mol/L的CH3COONa溶液的pH约为9 | |
| D. | 0.1molCH3COOH和0.1 mol NaOH恰好中和生成CH3COONa |
| A. | 将Al条投入NaOH溶液中:Al+4OH-=AlO2-+2H2O | |
| B. | 铜溶于浓硫酸中并加热:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 碳酸氢钙溶液中加入少量氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀硫酸:CO32-+H+=HCO3- |
| A. | K(HF)=c(F-)?c(H+)/c(HF ) | B. | K(HNO2)=7.2×10-4 | ||
| C. | 酸性强弱为 HF>HNO2 | D. | K(HNO2)<K(HF) |
 固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:CO2+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的热化学方程式是:CO2+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ