题目内容
14.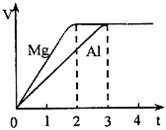 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )| A. | 反应消耗镁、铝的物质的量之比是3:2 | |
| B. | 反应消耗镁、铝的质量之比是3:2 | |
| C. | 与镁和铝反应的硫酸的物质的量之比是3:2 | |
| D. | 与镁和铝反应的硫酸的质量之比是3:2 |
分析 镁和铝分别与等浓度、等体积的过量稀硫酸反应,则金属完全反应,最终生成氢气体积相同,由氢原子守恒可知,消耗硫酸物质的量相等,金属提供电子相等,根据电子转移守恒计算二者物质的量之比,再根据m=nM计算质量之比.
解答 解:A.生成氢气相等,金属提供电子相等,则2n(Mg)=3n(Al),故n(Mg):n(Al)=3:2,故A正确;
B.参加反应的镁、铝的质量之比是3mol×24g/mol:2mol×27g/mol=4:3,故B错误;
C.镁和铝分别与等浓度、等体积的过量稀硫酸反应,则金属完全反应,最终生成氢气体积相同,由氢原子守恒可知,消耗硫酸物质的量相等,故C错误;
D.消耗硫酸的物质的量相等,则反应的硫酸的质量之比是1:1,故D错误,
故选:A.
点评 本题以图象形式考查化学方程式计算,注意利用守恒进行解答,较好的考查学生读图能力、分析计算能力,难度不大.

练习册系列答案
相关题目
5.下列化学用语表达正确的是( )
| A. | 明矾净水:Al3++3H2O?Al(OH)3↓+3H+ | |
| B. | 氯化铵溶于水:NH4++H2O?NH3•H2O+H+ | |
| C. | 亚硫酸溶液中:H2SO3?2H++SO32- | |
| D. | 在小苏打溶液中滴加氢氧化钠:HCO3-+OH-═CO2↑+H2O |
9.无色透明的溶液中能大量共存的离子组是( )
| A. | H+、Ca2+、Cl-、CH3COO- | B. | NH4+、Ca2+、HCO3-、SO42- | ||
| C. | K+、Ba2+、OH-、Cl- | D. | Cu2+、H+、Cl-、SO42- |
6.下列说法正确的是( )
| A. | 在常温、常压下11.2L N2含有的分子数为0.5NA | |
| B. | 标况下,22.4LH2的分子数为NA | |
| C. | 标况下,18g水的体积是22.4L | |
| D. | 1molSO2的体积是22.4L |
3.对下列未知盐的稀溶液所含离子的检验中,作出的判断一定正确的是( )
| A. | 加入氯化钡溶液不产生沉淀,再加入硝酸银溶液,有不溶于稀硝酸的白色沉淀生成,可判定含有Cl- | |
| B. | 先加稀盐酸酸化,无沉淀生成,再加BaCl2溶液,产生白色沉淀,可判定含有SO42- | |
| C. | 加入NaOH溶液,有白色沉淀产生,可判定含有Mg2+ | |
| D. | 加入盐酸后有无色、无味气体逸出,此气体能使澄清石灰水变浑浊,可判定含有CO32- |
 向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题: