题目内容
12.X、Y、Z、W是原子序数依次增大的四种短周期元素,p、q、r、s是上述四种元素形成的二元化合物,其中r是一种中学常见的两性氧化物,s是一种强酸,r与s的水溶液反应生成P与q.下列说法错误的是( )| A. | 简单离子半径:W>Y>Z | B. | 气态氢化物的沸点:Y>W | ||
| C. | Y与W可以形成多种二元化合物 | D. | p、q与r的化学键类型完全相同 |
分析 X、Y、Z、W是原子序数依次增大的四种短周期元素,p、q、r、s是上述四种元素形成的二元化合物,其中r是一种中学常见的两性氧化物,r为氧化铝;s是一种强酸,应该为氢化物,且都是短周期元素,则s为HCl,X为H元素,W为Cl元素;Y、Z只能为O、Al元素,结合原子序数大小可知Y为O、Z为Al元素;氧化铝与盐酸反应生成氯化铝和水,符合条件,据此进行解答.
解答 解:X、Y、Z、W是原子序数依次增大的四种短周期元素,p、q、r、s是上述四种元素形成的二元化合物,其中r是一种中学常见的两性氧化物,r为氧化铝;s是一种强酸,应该为氢化物,且都是短周期元素,则s为HCl,X为H元素,W为Cl元素;Y、Z只能为O、Al元素,结合原子序数大小可知Y为O、Z为Al元素;氧化铝与盐酸反应生成氯化铝和水,符合条件,
A.W、Y、Z分别为Cl、O、Al元素,氯离子含有电子层最多,其离子半径最大,氧离子和铝离子含有2个电子层,氧元素的原子序数减小,则氧离子的离子半径大于铝离子,则简单离子半径:W>Y>Z,故A正确;
B.W、Y分别为Cl、O,氢化物分别为HCl、H2O,水分子之间存在氢键,导致水的沸点较高,故B正确;
C.W、Y分别为Cl、O元素,二者可以形成Cl2O、ClO2、Cl2O7多种二元化合物,故C正确;
D.p、q与r为氯化铝、水、氧化铝,氯化铝含有共价键,水分子中含有共价键,氧化铝中含有离子键,它们的化学键类型不完全相同,故D错误;
故选D.
点评 本题考查位置、结构与性质关系的应用,题目难度不大,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,B为易错点,注意氢键对氢化物沸点的影响.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
3. 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X元素形成的化合物种类最多.下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X元素形成的化合物种类最多.下列说法错误的是( )
 短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X元素形成的化合物种类最多.下列说法错误的是( )
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中X元素形成的化合物种类最多.下列说法错误的是( )| A. | 原子半径:Z>W>X>Y | |
| B. | 工业上用Y和Z组成的化合物冶炼Z的单质 | |
| C. | X、Y形成的化合物一定为酸性氧化物 | |
| D. | W的单质和氧化物均可与NaOH溶液反应 |
20.设NA表示阿伏伽德罗常数的值.下列有关叙述正确的是( )
| A. | 50g 98%的硫酸中含有氧原子数目为2NA | |
| B. | 1L0.1 mol•L-1氨水中含有OH-的数目为0.1NA | |
| C. | 标准状况下,22.4L由CCl4和CH2O组成的混合物中含碳原子数目为NA | |
| D. | 常温常压下,足量的Al与1 molCl2共热充分反应后,转移电子数目为2NA |
7.某有机物N的结构简式如图所示,下列关于N的叙述错误的是( )
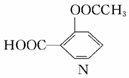

| A. | 分子式是C9H8O4 | |
| B. | 属于酯类化合物 | |
| C. | 1 molN 可以与1 mo1Na2CO3充分反应生成lmolCO2 | |
| D. | 一定条件下可发生加成反应和取代反应 |
17.化学与人类生活、生产息息相关,下列说法错误的是( )
| A. | CuSO4具有氧化性,因此用其制成的波尔多液可用作杀菌剂 | |
| B. | 回收的地沟油可以用来制造肥皂、提取甘油或生产生物柴油 | |
| C. | 绿色化学的核心是应用化学原理从源头上减少和消除工业生产对环境的污染 | |
| D. | 纤雏素属于多糖,但不是人类的营养物质 |
4.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 200g 63%的浓硝酸中含氧原子的数目为6NA | |
| B. | 已知C2H4(g)+H2(g)═C2H6(g)△H=-137.0kJ/mol,乙稀与H2加成时放出68.5kJ热量,则反应过程中被破坏的碳原子之间的共用电子对数目为NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标况下)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
15.下列离子组能大量共存的是( )
| A. | Fe3+、K+、OH-、Cl- | B. | Na+、Zn2+、CO32-、NO3- | ||
| C. | Mg2+、Na+、SO42-、Cl- | D. | Ba2+、CO32-、NO3-、K+ |