题目内容
9.在1.01×105Pa,20℃时,下列气体各2.8L,其质量最大的是( )| A. | N2 | B. | Cl2 | C. | NH3 | D. | SO2 |
分析 相同条件下,气体的气体摩尔体积相同,根据n=$\frac{V}{{V}_{m}}$可知等体积的气体具有相同的物质的量,再根据m=nM可知,气体的摩尔质量越大,氧气的质量越大,据此进行解答.
解答 解:在1.01×105Pa,20℃时气体摩尔体积相等,根据n=$\frac{V}{{V}_{m}}$可知等2.8L各气体具有相同的物质的量,
A.N2的摩尔质量为28g/mol;
B.Cl2的摩尔质量为71g/mol;
C.NH3的摩尔质量为17g/mol;
D.SO2的摩尔质量为64g/mol;
由于气体的质量m=nM,而物质的量n相等,则气体的质量与摩尔质量成正比,则气体质量最大的为氯气,
故选B.
点评 本题考查了物质的量的简单计算,题目难度不大,明确物质的量与气体摩尔体积、摩尔质量之间的关系为解答关键,试题侧重基础知识的考查,有利于提高学生的化学计算能力.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目
19.下列实验装置图所示的实验操作,不能达到相应的实验目的是( )
| A. | 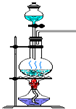 实验室制备氯气 | |
| B. | 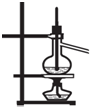 分离沸点相差较大的互溶液体混合物 | |
| C. |  向容量瓶中转移液体 | |
| D. | 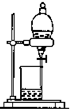 分离互不相溶的两种液体 |
17.下面是对四个实验绘制的图形,其中实验结果与图形对应准确的是( )

| A. | 图①是向一定量的稀盐酸和氯化钙的混合溶液中不断滴入碳酸钠溶液至过量 | |
| B. | 图②是用H2还原CuO来测定CuO中铜元素的含量 | |
| C. | 图③是向饱和的NaCl溶液中不断加水 | |
| D. | 图④是用适量的KClO3和MnO2混合物加热制O2 |
4.下列关于电解质溶液的叙述中正确的是( )
| A. | c(H+)等于1×10-7 mol•L-1的溶液一定是中性溶液 | |
| B. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| C. | 室温时,pH=2的CH3COOH和0.01 mol•L-1 NaOH溶液等体积混合,混合后pH=7 | |
| D. | 等物质的量浓度的Na2S和NaHS混合溶液中:2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)] |
14.下列四幅实验装置图,其中完全正确的是( )


| A. | 用Na检验乙醇中H原子的活泼性 | B. | 用乙醇和浓硫酸制取乙烯 | ||
| C. | 实验室模拟石油的分馏 | D. | 乙酸和乙醇的酯化反应 |
1.下列有关叙述中正确的是( )
| A. | CH4与P4的分子结构都是正四面体形,闪此在6.02×1023个CH4分子或P4分子中都含布4×6.02×1023个 共价键 | |
| B. | 在含6.02×1023个硅原子的二氧化硅晶体中含有4×6.02×1023个Si一O键 | |
| C. | 5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去 0.2×6.02×1023个电子 | |
| D. | 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子 |
18.已知:①向KMnO4晶体中滴加盐酸,产生黄绿色的气体;②向FeCl2溶液中通入少量的实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色.下列判断正确的是( )
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 | |
| B. | 上述实验中发生的反应都是氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 实验②可以证明Fe2+既有氧化性又有还原性 |
19.水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO${\;}_{3}^{2-}$、SO${\;}_{3}^{2-}$、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$中的若干种离子.某同学对该溶液进行了如下实验:
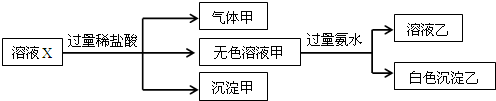
下列判断正确的是( )

下列判断正确的是( )
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸铝的混合物 | |
| C. | 所有阴离子都可能存在于溶液X中 | |
| D. | 沉淀乙可能是Mg(OH)2和Al(OH)3的混合物 |



 .
. ;
;