题目内容
在一定温度下可逆反应H2(g)+I2(g)?2HI(g) 达到平衡的标志是( )
| A、有1mol H-H键断裂,同时有1 mol I-I键形成 |
| B、容器内压强不再随时间而变化 |
| C、υ正(H2)=υ逆(HI) |
| D、H2、I2、HI的浓度之比为1:1:2 |
考点:化学平衡状态的判断
专题:
分析:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答:
解:A、有1mol H-H键断裂等效于有1 mol I-I键断裂,同时有1 mol I-I键形成,正逆反应速率相等,故A正确;
B、容器内压强始终不随时间而变化,故B错误;
C、速率之比不等于化学计量数之比,故C错误;
D、当体系达平衡状态时,H2、I2、HI的浓度之比可能为1:1:2,也可能不是1:1:2,与各物质的初始浓度及转化率有关,故D错误;
故选A.
B、容器内压强始终不随时间而变化,故B错误;
C、速率之比不等于化学计量数之比,故C错误;
D、当体系达平衡状态时,H2、I2、HI的浓度之比可能为1:1:2,也可能不是1:1:2,与各物质的初始浓度及转化率有关,故D错误;
故选A.
点评:本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA |
| B、0.1 mol?L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA |
| C、足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA |
| D、常温常压下,5.6g环丙烷和聚乙烯的混合物中含有的碳原子数为0.4NA |
5-羟色胺对人体睡眠具有调节作用,其结构简式如图所示.下列有关5-羟色胺说法错误的是( )

| A、该有机物分子式为C11H12N2O3 |
| B、该有机物分子中所有原子不可能共平面 |
| C、分子中含有1个手性碳原子 |
| D、1mol该物质最多可与4molH2或1molBr2发生反应 |
下列各组离子在溶液中能大量共存的是( )
| A、H+、Cl-、CH3COO-、NO3- |
| B、K+、AlO2-、NO3-、OH- |
| C、Fe3+、I-、SO42-、H+ |
| D、AlO2-、HCO3-、Na+、K+ |
某实验兴趣小组用0.1000mol/L的标准盐酸溶液测定未知NaOH溶液,进行了4次中和滴定,数据如下:该待测NaOH的浓度为( )
| 实验序号 | 待测液数据/mL | 标准液数据/mL | ||
| 滴定前 | 滴定后 | 取用前 | 取用后 | |
| 1 | 0.10 | 20.10 | 0.00 | 20.00 |
| 2 | 0.80 | 22.60 | 0.00 | 20.00 |
| 3 | 0.40 | 20.20 | 0.00 | 20.00 |
| 4 | 1.20 | 21.40 | 0.00 | 20.00 |
| A、0.1000 mol/L |
| B、0.0978 mol/L |
| C、0.9780 mol/L |
| D、0.1020 mol/L |
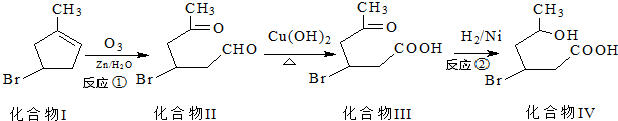
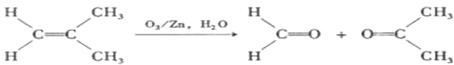
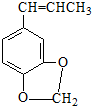 )发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
)发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
 ,
,