题目内容
4.某化学兴趣小组的同学欲利用如图所示装置验证浓硝酸与木炭反应时有NO2、CO2生成,并探究是否还有NO生成.(已知:NO2的沸点为21.1℃,NO的沸点为-151℃,CO2的沸点为-78.5℃;酸性KMnO4溶液能将NO氧化成为NO3-.)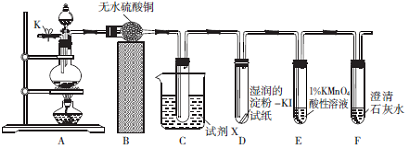
(1)装置经气密性检查后加入试剂并连接好仪器,然后打开开关K,通过导管向装置内通入氮气,其目的是排出装置内的空气,防止其对NO的检验的干扰.
(2)实验中用无水CuSO4代替无水CaCl2干燥气体的一个好处是可判断水蒸气是否全部被吸收;装置C用于检验、收集并除去NO2,试剂X是冰水(填名称),装置D的作用是检验二氧化氮是否已全部除去.
(3)若装置E中溶液的颜色慢慢褪去,则E中发生反应的离子方程式是5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;若装置E中没有明显的变化,装置C和F出现了预期的现象,则装置A中发生反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;若装置E、F中的试剂对调,则能(填“能”或“不能”)达到预期的实验目的,其判断理由是因为二氧化碳与酸性高锰酸钾溶液不反应,NO与石灰水不反应、
(4)将等物质的量的NO2、NO混合后通入低温下的水中只得到一种含氧酸X,该酸的化学式可能为HNO2.请设计一种实验方案,以确定含氧酸X与碳酸的酸性相对强弱:向装有碳酸氢钠的试管里滴加亚硝酸溶液,若有气泡产生,则亚硝酸的酸性相对较强,若无气泡产生,则亚硝酸的酸性相对较弱,或比较等物质的量浓度的亚硝酸钠溶液、碳酸氢钠溶液的PH大小,PH小的,对应的酸的酸性相对较强.
分析 探究实验,连接装置,检查装置的气密性,然后装药品,实验开始,打开开关K,通过导管向装置内通入氮气,排出装置内的空气,防止其对NO的检验的干扰,装置A:碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,装置B:无水硫酸铜和水反应生成蓝色五水合硫酸铜,证明生成的气体中有水蒸气,同时吸收气体中的水蒸气,装置C:NO2的沸点低,试剂X是冰水,收集二氧化氮,装置D:检验二氧化氮是否已全部除去,装置E:检验NO,5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,酸性高锰酸钾颜色慢慢褪去,装置F:检验二氧化碳,最后尾气处理.
(1)NO易被氧气氧化成二氧化氮,探究浓硝酸与木炭反应是否还有NO生成,需排尽装置中的空气;
(2)利用无水硫酸铜和水反应生成蓝色五水合硫酸铜,证明生成的气体中有水蒸气,同时吸收气体中的水蒸气,而无水CaCl2只能干燥气体;装置C用于检验、收集并除去NO2,装置为向上排气法,需利用二氧化氮的沸点低选择X成分;装置D中盛放的是淀粉碘化钾,若有氧化性的二氧化氮剩余,会氧化碘离子生成碘单质,碘单质与淀粉作用显示蓝色,所以D的作用为检验二氧化氮是否已全部除去;
(3)NO具有还原性,高锰酸根离子具有氧化性,两者反应生成硝酸根离子、+2价锰离子,装置A中为碳和浓硝酸反应,生成二氧化氮、二氧化碳、水,因为二氧化碳与酸性高锰酸钾溶液不反应,NO与石灰水不反应若装置E、F中的试剂对调,能达到预期的实验目的;
(4)将等物质的量的NO2、NO混合后通入低温下的水中发生价态归中反应生成亚硝酸,证明亚硝酸与碳酸的酸性相对强弱,可利用强酸制弱酸的原理,或比较等物质的量浓度的亚硝酸盐溶液的PH等角度设计实验.
解答 解:(1)根据实验的目的,验证浓硝酸与木炭反应时有NO2、CO2生成,并探究是否还有NO生成,NO易被氧气氧化成二氧化氮,所以需用与NO不反应的气体,排尽装置中的氧气,所以实验开始,打开开关K,通过导管向装置内通入氮气,
故答案为:排出装置内的空气,防止其对NO的检验的干扰;
(2)无水CaCl2只能干燥气体,无明显现象,无水硫酸铜为白色粉末,无水硫酸铜和水反应生成蓝色五水合硫酸铜,证明生成的气体中有水蒸气,同时吸收气体中的水蒸气;NO2的沸点为21.1℃,沸点低易液化,装置C为向上排气法,X成分为冰水,用于冷却、收集并除去NO2,装置D中盛放的是淀粉碘化钾,若有氧化性的二氧化氮剩余,会氧化碘离子生成碘单质,碘单质与淀粉作用显示蓝色,所以D的作用为检验二氧化氮是否已全部除去,
故答案为:可判断水蒸气是否全部被吸收;冰水;检验二氧化氮是否已全部除去;
(3)在酸性溶液中,NO可将MnO4-还原为Mn2+,NO氧化生成NO3-,反应中元素的化合价变化为 NO→NO3-,氮元素由+2价→+5价,化合价升高3价;MnO4-→Mn2+,锰元素由+7价→+2价,化合价降低5价,所以其最小公倍数为15,故NO的系数为5,高锰酸根离子的系数为3,其它元素根据原子守恒配平,所以反应的离子方程式为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,碳单质和浓硝酸加热反应生成二氧化氮、二氧化碳和水,反应的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,因为二氧化碳不具有还原性,与酸性高锰酸钾溶液不反应,NO与石灰水不反应,若装置E、F中的试剂对调,能达到预期的实验目的,
故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;能;因为二氧化碳与酸性高锰酸钾溶液不反应,NO与石灰水不反应;
(4)将等物质的量的NO2、NO混合后通入低温下的水中发生价态归中反应,反应方程式为:NO2+NO+H2O=2HNO2,证明亚硝酸与碳酸的酸性相对强弱,可利用强酸制弱酸的原理,
向装有碳酸氢钠的试管里滴加亚硝酸溶液,若有气泡产生,则亚硝酸的酸性相对较强,若无气泡产生,则亚硝酸的酸性相对较弱,或比较等物质的量浓度的亚硝酸盐溶液的PH,比较等物质的量浓度的亚硝酸钠溶液、碳酸氢钠溶液的PH大小,PH小的,对应的酸的酸性相对较强,
故答案为:向装有碳酸氢钠的试管里滴加亚硝酸溶液,若有气泡产生,则亚硝酸的酸性相对较强,若无气泡产生,则亚硝酸的酸性相对较弱,或比较等物质的量浓度的亚硝酸钠溶液、碳酸氢钠溶液的PH大小,PH小的,对应的酸的酸性相对较强.
点评 本题考查了浓硝酸与木炭反应产物的检验,侧重考查实验过程分析,物质性质的实验探究,明确物质性质和实验操作的目的和实验步骤分析是解题关键,注意结合题给信息解答,题目难度中等.

| A. | NH${\;}_{4}^{+}$→NH3 | B. | S→S2- | C. | HCl→Cl2 | D. | CO32-→CO2 |
| A. | 钾 | B. | 镓 | C. | 铁 | D. | 钋 |
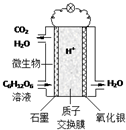 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 电池工作时,H+向石墨电极移动 | |
| B. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| C. | 石墨电极上反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | 该电池每转移4mol电子,石墨电极产生33.6LCO2气体(标准状况) |
| A. | 混合气体密度保持不变 | |
| B. | 单位时间内生成n mol A,同时生成3n mol B | |
| C. | 混合气体的压强保持不变 | |
| D. | C生成的速率与A分解的速率相等 |
| A. | 增加反应物的量 | B. | 增加压强 | C. | 升高温度 | D. | 缩小容器的体积 |
 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: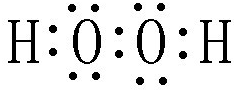 .
. 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题: