题目内容
6.下列变化需要加入氧化剂才能实现的是( )| A. | NH${\;}_{4}^{+}$→NH3 | B. | S→S2- | C. | HCl→Cl2 | D. | CO32-→CO2 |
分析 需要加入氧化剂才能实现,则选项中为还原剂的氧化反应,还原剂中某元素的化合价升高,以此来解答.
解答 解:A.NH4+→NH3中,没有元素的化合价变化,不需要加氧化剂,故A不选;
B.S→S2-中,S元素的化合价降低,需要加还原剂,故B不选;
C.HCl→Cl2中,Cl元素的化合价升高,需要加氧化剂,故C选;
D.CO32-→CO2中,没有元素的化合价变化,不需要加氧化剂,故D不选;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化剂、还原剂反应的考查,题目难度不大.

练习册系列答案
相关题目
14.乙醇可以发生下列反应,在反应里乙醇分子断裂C-O键而失去羟基的是( )
| A. | 乙醇与乙酸发生酯化反应 | B. | 乙醇的催化氧化 | ||
| C. | 乙醇与钠反应生成氢气 | D. | 乙醇在浓硫酸存在下加热至170℃ |
 ;
;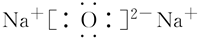 .
.