题目内容
19.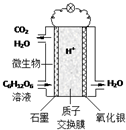 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 电池工作时,H+向石墨电极移动 | |
| B. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| C. | 石墨电极上反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | 该电池每转移4mol电子,石墨电极产生33.6LCO2气体(标准状况) |
分析 微生物原料电池中,负极上是污水中的微生物发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,根据电极反应式进行回答判断.
解答 解:A、注入污水的石墨一极是电池的负极,电池工作时,H+向正极即氧化银电极移动,故A错误;
B、注入污水的石墨一极是电池的负极,氧化银电极是正极,该电极上反应为氧气得电子的还原反应,故B错误;
C、污水中的有机物在微生物作用下分解放出电子和质子,即注入污水的石墨一极是电池的负极,发生失电子的氧化反应C6H12O6+6H2O-24e-═6CO2↑+24H+,故C正确;
D、注入污水的一极是电池的负极,负极上C6H12O6失电子,电极反应式为C6H12O6+6H2O-24e-=6CO2+24H+,每转移4mol电子,石墨电极产生22.4LCO2,故D错误.
故选C.
点评 本题考查学生原电池的工作原理以及电极反应式的书写知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
8.NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,1 L庚烷所含有的分子数为$\frac{{N}_{A}}{22.4}$ | |
| B. | 1 mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4 L,所含的电子数约为16NA | |
| D. | 26 g C2H2和苯蒸气的混合气体中所含的C原子数为2NA |
9.在冶金工业上,均不能用热还原法制得的金属组是( )
| A. | Na、Fe、Al | B. | Na、K、Zn | C. | Fe、Cu、Ag | D. | Na、Ca、K |
 .
.
 如图所示装置:
如图所示装置: