题目内容
向100mL 0.018mol/L的AgNO3溶液中加入100mL 0.02mol/L的盐酸,生成沉淀.已知AgCl(s)的溶度积常数Ksp=c(Ag+)×c(Cl-)=1×10-10.(混合后溶液的体积变化忽略不计).试计算:
(1)沉淀生成后溶液中Cl-的浓度.
(2)沉淀生成后溶液中Ag+的浓度.
(1)沉淀生成后溶液中Cl-的浓度.
(2)沉淀生成后溶液中Ag+的浓度.
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:依据题干数据计算沉淀后溶液中氯离子浓度,结合Ksp计算溶液中银离子浓度.
解答:
解:(1)向100ml0.018mol/L的AgNO3溶液中加入100ml0.02mol/L的盐酸,混合后两者浓度分别为
c(Ag+)=
=0.009 mol/L,
c(Cl-)=
=0.01mol/L,
Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.01-0.009=0.001mol/L,答:沉淀生成后溶液中Cl-的浓度为1×10-3mol/L;
(2)Ksp=c(Ag+)×C(Cl-)=1.0×10-10,则:c(Ag+)=
=1.0×10-7mol/L;答:沉淀生成后溶液中Ag+的浓度为1×10-7mol/L.
c(Ag+)=
| 0.018 |
| 2 |
c(Cl-)=
| 0.02 |
| 2 |
Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.01-0.009=0.001mol/L,答:沉淀生成后溶液中Cl-的浓度为1×10-3mol/L;
(2)Ksp=c(Ag+)×C(Cl-)=1.0×10-10,则:c(Ag+)=
| 1.0×10-10 |
| 0.001 |
点评:本题考查溶液浓度的计算,本题难度不大,做题时注意判断两种物质的反应程度,再根据溶度积常数计算.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
工业生产硫酸可表示为:FeS2→SO2→SO3→H2SO4
已知:FeS2(s)+
O2(g)═
Fe2O3(s)+2SO2(g);△H═-853kJ?mol-1
2SO2(g)+O2(g)═2SO3(g);△H═-196.6kJ?mol-1
SO3(g)+H2O(l)═H2SO4(l);△H═-130.3kJ?mol-1
则1mol FeS2完全转化为H2SO4的反应热等于( )
已知:FeS2(s)+
| 11 |
| 4 |
| 1 |
| 2 |
2SO2(g)+O2(g)═2SO3(g);△H═-196.6kJ?mol-1
SO3(g)+H2O(l)═H2SO4(l);△H═-130.3kJ?mol-1
则1mol FeS2完全转化为H2SO4的反应热等于( )
| A、-130.3kJ?mol-1 |
| B、-1310.2kJ?mol-1 |
| C、-1179.kJ?mol-1 |
| D、-853kJ?mol-1 |
化学与科学、技术、社会、环境密切相关,下列有关说法正确的是( )
| A、锅炉水垢中的硫酸钙可用碳酸钠溶液处理,使之转化为碳酸钙,再用酸除去 |
| B、日本福岛核电站爆炸时释放的两种放射性核素13153I与13755Cs的中子数相等 |
| C、铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝 |
| D、海水淡化可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 |



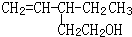 具有一定的光学活性,请你列举两种使该物质失去光学活性的方法
具有一定的光学活性,请你列举两种使该物质失去光学活性的方法