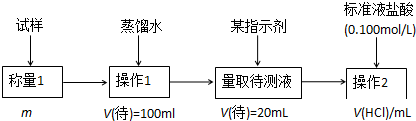
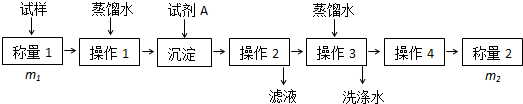
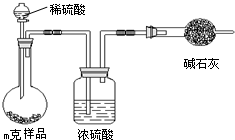
题目内容
14.1mol O2在放电条件下发生下列反应:3O2$\frac{\underline{\;放电\;}}{\;}$2O3,如有30%O2转化为O3,(1)求放电后混合气体的平均摩尔质量.
(2)放电后混合气体对H2的相对密度.
分析 1molO2只有0.3mol转化为0.2molO3,反应后气体的总物质的量为0.7mol+0.2mol=0.9mol,结合M=$\frac{m}{n}$、d=$\frac{{M}_{混}}{{M}_{氢气}}$计算.
解答 解:由反应及信息可知,1molO2只有0.3mol转化为0.2molO3,反应后气体的总物质的量为0.7mol+0.2mol=0.9mol,
(1)放电后混合气体的平均摩尔质量为$\frac{32g}{0.9mol}$=35.56g/mol,
答:放电后混合气体的平均摩尔质量为35.56g/mol;
(2)放电后混合气体对H2的相对密度为$\frac{35.56}{2}$=17.78,
答:放电后混合气体对H2的相对密度为17.78.
点评 本题考查物质的量的计算,为高频考点,把握平均摩尔质量、相对密度的计算方法为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.

练习册系列答案
相关题目
4.下列关于电解质溶液的叙述中正确的是( )
| A. | c(H+)等于1×10-7 mol•L-1的溶液一定是中性溶液 | |
| B. | 0.2 mol•L-1 CH3COOH溶液中的c(H+)是0.1 mol•L-1 CH3COOH溶液中的c(H+)的2倍 | |
| C. | 室温时,pH=2的CH3COOH和0.01 mol•L-1 NaOH溶液等体积混合,混合后pH=7 | |
| D. | 等物质的量浓度的Na2S和NaHS混合溶液中:2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)] |
2.氢氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-=2H2O和$\frac{1}{2}$O2+H2O+2e-=2OH-,则下列叙述正确的是( )
| A. | 通H2的一极是正极,通O2的一极是负极 | |
| B. | 通O2的一极是正极,通H2的一极是负极 | |
| C. | 工作一段时间后电解质溶液pH增大 | |
| D. | 工作时负极区附近pH不变 |
19.水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO${\;}_{3}^{2-}$、SO${\;}_{3}^{2-}$、HCO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$中的若干种离子.某同学对该溶液进行了如下实验:
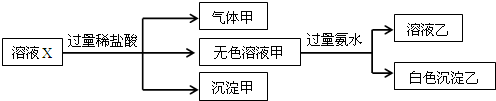
下列判断正确的是( )

下列判断正确的是( )
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸铝的混合物 | |
| C. | 所有阴离子都可能存在于溶液X中 | |
| D. | 沉淀乙可能是Mg(OH)2和Al(OH)3的混合物 |
6.同温同压下,质量忽略不计的两气球A和B,分别充入X气体和Y气体,且充气后两气球的体积相同,若相同条件下,A气球放在CO中静止不动,B气球放在O2中上浮,则下列叙述或表示中正确的是( )
| A. | X气体的相对分子质量比Y气体的相对分子质量大 | |
| B. | X可能是C2H4,Y可能是CH4 | |
| C. | X气体的密度小于Y气体的密度 | |
| D. | 充气后A气球质量比B气球质量大 |
16.若在飞船的太空实验室中进行以下实验,其中最难完成的是( )
| A. | 将金粉和铁粉混合 | B. | 将牛奶加入水中混合 | ||
| C. | 蒸发食盐水制取食盐晶体 | D. | 用漏斗、滤纸过滤除去水中的泥沙 |
17.用水能鉴别的一组物质是( )
| A. | 乙醇和乙酸 | B. | 乙酸乙酯和乙醇 | C. | 苯和乙酸乙酯 | D. | 四氯化碳和溴苯 |