题目内容
某研究性学习小组为了测定某品牌合金中铝的含量,现设计了如图实验:已知:
(1)该铝合金的主要成分为铝、镁、铜、硅.
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O═Na2SiO3+2H2↑.
请回答下列问题:
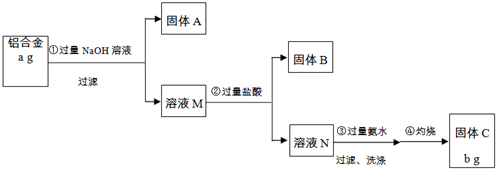
(1)固体A的成分是 ;
(2)生成固体B的离子方程式为 ;步骤③中生成沉淀的离子方程式为 ;
(3)检验步骤③中沉淀是否洗涤干净的实验操作为 ;
(4)该样品中铝的质量分数是 ;(用a、b表示)
(5)下列因操作不当,会使测定结果偏大的是 ;
A.第①步中加入NaOH溶液不足 B.第②步中加入盐酸不足时
C.第③步中沉淀未用蒸馏水洗涤 D.第④步对沉淀灼烧不充分.
(1)该铝合金的主要成分为铝、镁、铜、硅.
(2)常温下,硅能和NaOH发生反应:Si+2NaOH+H2O═Na2SiO3+2H2↑.
请回答下列问题:

(1)固体A的成分是
(2)生成固体B的离子方程式为
(3)检验步骤③中沉淀是否洗涤干净的实验操作为
(4)该样品中铝的质量分数是
(5)下列因操作不当,会使测定结果偏大的是
A.第①步中加入NaOH溶液不足 B.第②步中加入盐酸不足时
C.第③步中沉淀未用蒸馏水洗涤 D.第④步对沉淀灼烧不充分.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:铝合金的主要成分为铝、镁、铜、硅加入过量氢氧化钠溶液过滤,固体A为Mg、Cu,溶液M为NaAlO2,Na2SiO3,溶液M中加入过量盐酸反应过滤得到固体B为H2SiO3,溶液N中为AlCl3溶液加入过量氨水过滤洗涤得到氢氧化铝沉淀灼烧得到固体C为Al2O3;
(1)依据上述分析可知固体A为Mg、Cu,;
(2)B为硅酸钠和盐酸反应生成硅酸沉淀得 反应,步骤③是氯化铝和一水合氨反应生成氢氧化铝沉淀的反应;
(3)沉淀表面沾有氯化铵溶液,检验最后一次洗涤液中是否含有氯离子设计实验证明;
(4)分析可知固体C为Al2O3,依据铝元素守恒计算;
(5)A.第①步中加入NaOH溶液不足,铝为全部溶解,测定结果偏低;
B.第②步中加入盐酸不足时,生成的偏铝酸钠为全部反应导致最后生成的氧化铝质量减小,结果偏低;
C.第③步中沉淀未用蒸馏水洗涤,表面有杂质氯化钠、氯化铵,灼烧氯化铵分解,氯化钠对测定结果固体C质量增大;
D.第④步对沉淀灼烧不充分,得到固体C质量增大.
(1)依据上述分析可知固体A为Mg、Cu,;
(2)B为硅酸钠和盐酸反应生成硅酸沉淀得 反应,步骤③是氯化铝和一水合氨反应生成氢氧化铝沉淀的反应;
(3)沉淀表面沾有氯化铵溶液,检验最后一次洗涤液中是否含有氯离子设计实验证明;
(4)分析可知固体C为Al2O3,依据铝元素守恒计算;
(5)A.第①步中加入NaOH溶液不足,铝为全部溶解,测定结果偏低;
B.第②步中加入盐酸不足时,生成的偏铝酸钠为全部反应导致最后生成的氧化铝质量减小,结果偏低;
C.第③步中沉淀未用蒸馏水洗涤,表面有杂质氯化钠、氯化铵,灼烧氯化铵分解,氯化钠对测定结果固体C质量增大;
D.第④步对沉淀灼烧不充分,得到固体C质量增大.
解答:
铝合金的主要成分为铝、镁、铜、硅加入过量氢氧化钠溶液过滤,固体A为Mg、Cu,溶液M为NaAlO2,Na2SiO3,溶液M中加入过量盐酸反应过滤得到固体B为H2SiO3,溶液N中为AlCl3溶液加入过量氨水过滤洗涤得到氢氧化铝沉淀灼烧得到固体C为Al2O3;
(1)依据上述分析可知固体A为Mg、Cu;
故答案为:Mg、Cu;
(2)B为硅酸钠和盐酸反应生成硅酸沉淀的反应,离子方程式为:SiO32-+2H+=H2SiO3↓,步骤③是氯化铝和一水合氨反应生成氢氧化铝沉淀的反应,离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
故答案为:SiO32-+2H+=H2SiO3↓,Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(3)沉淀表面沾有氯化铵、氯化钠溶液,检验最后一次洗涤液中是否含有氯离子设计实验证明,取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净;
故答案为:取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净;
(4)分析可知bg固体C为Al2O3,依据铝元素守恒计算,铝的质量分数=
×100%=
×100%;
故答案为:
×100%;
(5)A.第①步中加入NaOH溶液不足,铝为全部溶解,测定结果偏低,故A不符合;
B.第②步中加入盐酸不足时,生成的偏铝酸钠为全部反应导致最后生成的氧化铝质量减小,结果偏低,故B不符合;
C.第③步中沉淀未用蒸馏水洗涤,表面有杂质氯化钠、氯化铵,灼烧氯化铵分解,氯化钠对测定结果固体C质量增大,铝质量分数增大,故C正确;
D.第④步对沉淀灼烧不充分,得到固体C质量增大,铝质量分数增大,故D正确;
故答案为:C D;
(1)依据上述分析可知固体A为Mg、Cu;
故答案为:Mg、Cu;
(2)B为硅酸钠和盐酸反应生成硅酸沉淀的反应,离子方程式为:SiO32-+2H+=H2SiO3↓,步骤③是氯化铝和一水合氨反应生成氢氧化铝沉淀的反应,离子方程式为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
故答案为:SiO32-+2H+=H2SiO3↓,Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(3)沉淀表面沾有氯化铵、氯化钠溶液,检验最后一次洗涤液中是否含有氯离子设计实验证明,取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净;
故答案为:取最后一次洗涤液,加入AgNO3溶液,如产生白色沉淀,则没有洗涤干净;反之则洗涤干净;
(4)分析可知bg固体C为Al2O3,依据铝元素守恒计算,铝的质量分数=
| ||
| ag |
| 9b |
| 17a |
故答案为:
| 9b |
| 17a |
(5)A.第①步中加入NaOH溶液不足,铝为全部溶解,测定结果偏低,故A不符合;
B.第②步中加入盐酸不足时,生成的偏铝酸钠为全部反应导致最后生成的氧化铝质量减小,结果偏低,故B不符合;
C.第③步中沉淀未用蒸馏水洗涤,表面有杂质氯化钠、氯化铵,灼烧氯化铵分解,氯化钠对测定结果固体C质量增大,铝质量分数增大,故C正确;
D.第④步对沉淀灼烧不充分,得到固体C质量增大,铝质量分数增大,故D正确;
故答案为:C D;
点评:本题考查了物质组成的实验测定过程分析判断,物质性质的理解应用,实验基本操作的熟练掌握是解题关键,题目难度中等.

练习册系列答案
相关题目
设NA表示阿伏加德罗常数,下列说法正确的是( )
| A、1L 1mol/L的FeCl3液中含Fe3+的数目为NA |
| B、室温下,21.0g乙烯和丁烯的混合气体中含有的子数目为1.5NA |
| C、标准状况下,2.24LCl2与足量稀NaOH溶液反应,转移的电子总数为0.2NA |
| D、18gNH4-中含有的质子数为0.1NA |
下列各组离子一定能大量共存的是( )
| A、加入KSCN溶液显血红色的溶液中:Fe2+、Mg2+、Cl-、SO42- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20 (mol?L-1)2的溶液中:Na+、ClO-、S2-、NH4+ |
| D、在AlCl3溶液中,Na+、AlO2-、NO3-、SO42- |
下列有关实验操作或仪器的使用正确的是( )
A、 除去氯气中的氯化氢 |
B、 制备Fe(OH)2 |
C、 实验室制备氨气 |
D、 保存浓硝酸 |
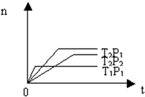 反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )| A、T1<T2,P1<P2 |
| B、T1<T2,P1>P2 |
| C、T1>T2,P1>P2 |
| D、T1>T2,P1<P2 |
 碘在科研与生活中有重要应用.某一兴趣小组用0.50mol?L-1 KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用.某一兴趣小组用0.50mol?L-1 KI、0.2%淀粉溶液、0.20mol?L-1K2S2O8、0.10mol?L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.

 (1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.
(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.现将0.04mol?L-1HA溶液和0.02mol?L-1NaOH溶液等体积混合,得到缓冲溶液.