题目内容
A、B、C、D、E均为易溶于水的化合物,其离子组成如表.(各化合物中离子组成不重复),分别取溶液进行如下实验:
①用pH试纸分别测得B、C溶液均呈碱性,且0.1mol/L B溶液pH>13
②D溶液加入铜粉,溶液增加
③在E溶液中加过量B,没有沉淀产生
④在A溶液中逐字滴滴入氨水至过量,先生成白色沉淀,后沉淀溶解
请回答下列问题:
(1)B的名称: E的名称: ;
(2)C水溶液呈碱性原因(用离子方程式表示) ;0.1mol/L的C溶液中和0.1mol/L的NaHCO3溶液中,阴离子的总数:C溶液 NaHCO3溶液;(填“>”、“=”或“<”,下同)
(3)D溶液呈 性;(填“酸性”、“碱性”或“中性”)若将D溶液加热蒸干得到固体应是: (填化学式)
| 阳离子 | Na+,Al3+,Ag+,Ba2+,Fe3+ |
| 阴离子 | Cl-,CO32-,SO42-,NO3-,OH- |
②D溶液加入铜粉,溶液增加
③在E溶液中加过量B,没有沉淀产生
④在A溶液中逐字滴滴入氨水至过量,先生成白色沉淀,后沉淀溶解
请回答下列问题:
(1)B的名称:
(2)C水溶液呈碱性原因(用离子方程式表示)
(3)D溶液呈
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:①用pH试纸测得B和C溶液显碱性,溶液可能为碱溶液或强碱弱酸盐,0.1mol/L的B溶液pH大于13,则1molB中含有不止1mol氢氧根离子,根据离子共存可知,B为氢氧化钡;C只能为碱性溶液,含有CO32-离子,结合离子共存可知,C只能为碳酸钠;
②在D溶液中加入铜粉,溶液质量,说明D中含有铁离子;
③在E溶液中加入过量B,没有沉淀产生,说明E中没有SO42-、CO32-,所以E是氯化铝,则D为硫酸铁,
④在A溶液中逐滴加入氨水,有白色沉淀生成,继续加氨水至过量,沉淀消失,说明沉淀应该是氢氧化银,所以A溶液中含有银离子,则A只能是硝酸银;据此解答各小题即可.
②在D溶液中加入铜粉,溶液质量,说明D中含有铁离子;
③在E溶液中加入过量B,没有沉淀产生,说明E中没有SO42-、CO32-,所以E是氯化铝,则D为硫酸铁,
④在A溶液中逐滴加入氨水,有白色沉淀生成,继续加氨水至过量,沉淀消失,说明沉淀应该是氢氧化银,所以A溶液中含有银离子,则A只能是硝酸银;据此解答各小题即可.
解答:
解:依据分析可知:A为硝酸银,B为氢氧化钡,C为碳酸钠,D为硫酸铁,E为氯化铝,
(1)B为氢氧化钡,E为氯化铝,故答案为:氢氧化钡;氯化铝;
(2)碳酸根水解生成碳酸氢根和氢氧根,故使得溶液显碱性,Na2CO3溶液中CO32-的水解大于NaHCO3中HCO3-的水解,则Na2CO3中阴离子浓度之和大,故答案为:CO32-+H2O?HCO3-+OH-,>;
(3)由于;硫酸铁为强酸弱酸盐,故铁离子水解致使溶于呈酸性,铁离子水解产物为硫酸,硫酸不挥发,故蒸干硫酸铁溶液,仍得到硫酸铁,故答案为:酸;Fe2(SO4)3.
(1)B为氢氧化钡,E为氯化铝,故答案为:氢氧化钡;氯化铝;
(2)碳酸根水解生成碳酸氢根和氢氧根,故使得溶液显碱性,Na2CO3溶液中CO32-的水解大于NaHCO3中HCO3-的水解,则Na2CO3中阴离子浓度之和大,故答案为:CO32-+H2O?HCO3-+OH-,>;
(3)由于;硫酸铁为强酸弱酸盐,故铁离子水解致使溶于呈酸性,铁离子水解产物为硫酸,硫酸不挥发,故蒸干硫酸铁溶液,仍得到硫酸铁,故答案为:酸;Fe2(SO4)3.
点评:本题考查离子浓度大小的比较及盐类水解及水解趋势的大小,题目有一定难度.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
已知下列热化学方程式:H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol,H2(g)+
O2(g)═H2O(g)△H=-241.8kJ/mol则氢气的标准燃烧热是( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、-285.8kJ/mol |
| B、285.8kJ/mol |
| C、-241.8kJ/mol |
| D、241.8kJ/mol |
实验室中需要配制2mol?L-1的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A、950 mL,111.2 g |
| B、500 mL,117 g |
| C、1 000 mL,117 g |
| D、1 000 mL,111.2 g |
下列除杂,所用试剂和操作均正确的是( )
| 选项 | 物质成分(括号内为杂质) | 所用试剂 | 操作 |
| A | 铁屑(油污) | 纯碱溶液 | 洗涤 |
| B | 苯(苯酚) | 溴水 | 过滤 |
| C | 碳酸钡(硫酸钡) | 盐酸 | 溶解、过滤 |
| D | 乙醇(乙酸) | 烧碱溶液 | 分液 |
| A、A | B、B | C、C | D、D |
溴乙烷与氢氧化钾溶液共热,既可生成乙烯又可生成乙醇,其条件区别是( )
| A、生成乙烯的是热的氢氧化钾的水溶液 |
| B、生成乙醇的是热的氢氧化钾的水溶液 |
| C、生成乙烯的是在170℃下进行的 |
| D、生成乙醇的是热的氢氧化钾的醇溶液 |
下列反应能用化合直接制得的是( )
①FeCl2②FeCl3③Fe(OH)3④Fe(OH)2⑤Cu2S.
①FeCl2②FeCl3③Fe(OH)3④Fe(OH)2⑤Cu2S.
| A、①②③⑤ | B、②⑤ |
| C、②③⑤ | D、全部 |
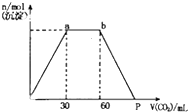 向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )
向Ba(OH)2和KOH混合液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体体积VmL的关系如图所示,下列结论中正确的是( )| A、原混合物中n[Ba(OH)2]:n(KOH)=1:2 |
| B、p点坐标为120mL |
| C、p点溶液中溶质为Ba(HCO3)2 |
| D、a,b段反应分二阶段,离子方程式为:CO2+2OH-=CO32-+H2O CO32-+H2O+CO2=2HCO3- |
 ;B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.请回答:
;B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.请回答: