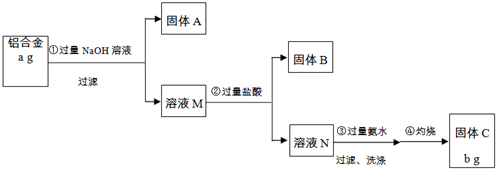
题目内容
下列各组离子一定能大量共存的是( )
| A、加入KSCN溶液显血红色的溶液中:Fe2+、Mg2+、Cl-、SO42- |
| B、能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Fe2+ |
| C、常温下水电离出的c(H+)?c(OH-)=10-20 (mol?L-1)2的溶液中:Na+、ClO-、S2-、NH4+ |
| D、在AlCl3溶液中,Na+、AlO2-、NO3-、SO42- |
考点:离子共存问题
专题:
分析:A.加入KSCN溶液显血红色的溶液,含Fe3+;
B.能与金属铝反应放出氢气的溶液,为非氧化性酸或强碱溶液;
C.常温下水电离出的c(H+)?c(OH-)=10-20 (mol?L-1)2的溶液,为酸或碱溶液;
D.离子之间相互促进水解.
B.能与金属铝反应放出氢气的溶液,为非氧化性酸或强碱溶液;
C.常温下水电离出的c(H+)?c(OH-)=10-20 (mol?L-1)2的溶液,为酸或碱溶液;
D.离子之间相互促进水解.
解答:
解:A.加入KSCN溶液显血红色的溶液,含Fe3+,该组离子之间不反应,可大量共存,故A正确;
B.能与金属铝反应放出氢气的溶液,为非氧化性酸或强碱溶液,碱性溶液中不能大量存在Fe2+,酸性溶液中H+、NO3-、Al发生氧化还原反应不生成氢气,故B错误;
C.常温下水电离出的c(H+)?c(OH-)=10-20 (mol?L-1)2的溶液,为酸或碱溶液,酸性溶液中不能存在ClO-、S2-,且ClO-、S2-发生氧化还原反应,碱性溶液中不能大量存在NH4+,故C错误;
D.Al3+、AlO2-离子之间相互促进水解生成沉淀,不能大量共存,故D错误;
故选A.
B.能与金属铝反应放出氢气的溶液,为非氧化性酸或强碱溶液,碱性溶液中不能大量存在Fe2+,酸性溶液中H+、NO3-、Al发生氧化还原反应不生成氢气,故B错误;
C.常温下水电离出的c(H+)?c(OH-)=10-20 (mol?L-1)2的溶液,为酸或碱溶液,酸性溶液中不能存在ClO-、S2-,且ClO-、S2-发生氧化还原反应,碱性溶液中不能大量存在NH4+,故C错误;
D.Al3+、AlO2-离子之间相互促进水解生成沉淀,不能大量共存,故D错误;
故选A.
点评:本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应及氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
下列相关反应的离子方程式书写正确的是( )
| A、氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B、硫酸铜溶液显酸性:Cu2++2H2O═Cu(OH)2↓+2H+ |
| C、向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-=NH3↑+H2O |
| D、用酸化的高锰酸钾溶液氧化双氧水:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
关于硝酸的叙述中不正确的是( )
| A、浓硝酸与浓盐酸一样,在空气中出现白雾 |
| B、硝酸见光分解和受热分解产物相同,都是NO2、O2和H2O |
| C、NO2与水反应有硝酸生成,所以NO2是硝酸酸酐 |
对由X、Y元素形成的化合物X2Y2的叙述正确的是( )
| A、若是离子化合物,则阳阴离子个数比肯定不等于1:1 |
| B、若该化合物有Y-Y键,则肯定是共价化合物 |
| C、若溶于水时有X-Y键的断裂,则肯定是强电解质 |
| D、若X、Y原子间的共价键键能大,则熔、沸点肯定高 |
下列物质中,属于酸酐的是( )
| A、NO2 |
| B、CO |
| C、SO2 |
| D、CuO |
溴乙烷与氢氧化钾溶液共热,既可生成乙烯又可生成乙醇,其条件区别是( )
| A、生成乙烯的是热的氢氧化钾的水溶液 |
| B、生成乙醇的是热的氢氧化钾的水溶液 |
| C、生成乙烯的是在170℃下进行的 |
| D、生成乙醇的是热的氢氧化钾的醇溶液 |
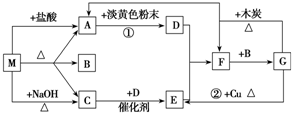
 ;B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.请回答:
;B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如图所示.请回答: