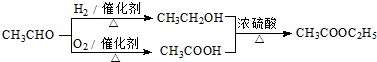题目内容
2.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用如图中的实验装置进行实验,证明过氧化钠可作供氧剂.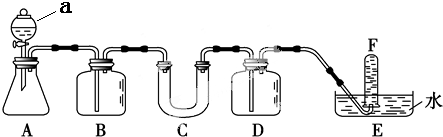
(1)写出仪器a的名称分液漏斗.
(2)A是实验室制取CO2的装置.写出A中发生反应的离子方程式:CaCO3+2H+═CO2↑+H2O+Ca2+.
(3)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和碳酸氢钠溶液 | |
| D |
(5)若将钠和过氧化钠的混合物12.4g与足量的水反应后,生成的气体在电火花用下恰好完全反应,且所得溶液的体积为100mL,则所得溶液的物质的量浓度是4mol•L-1.
分析 为证明过氧化钠可作供氧剂,实验中需要的反应物是二氧化碳和过氧化钠,根据题中装置可知,A是二氧化碳气体的制备装置,实验室用碳酸钙和稀盐酸制二氧化碳,制得的二氧化碳中含氯化氢气体,B是二氧化碳的净化装置,用饱和碳酸氢钠溶液除去氯化氢,在C中放置过氧钠固体与二氧化碳反应产生氧气,F是收集氧气的装置,最后对F收集到的气体进行检验,检验氧气前需除掉混在氧气中的二氧化碳,用D装置氢氧化钠溶液吸收,据此解答.
(1)仪器a是分液漏斗;
(2)碳酸钙与盐酸反应生成二氧化碳、氯化钙、水;
(3)C中装有过氧化钠,HCl与过氧化钠要发生反应,饱和碳酸氢钠溶液可除去CO2中的HCl气体,二氧化碳与过氧化钠反应生成碳酸钠和氧气,从C装置出来的气体中为氧气和未反应的二氧化碳,用盛有氢氧化钠溶液的D装置除去二氧化碳;
(4)过氧化钠与二氧化碳反应生成碳酸钠和氧气;
(5)设出Na2O2、Na的物质的量分别为x mol、y mol,根据方程式2Na2O2+2H2O=4NaOH+O2↑、2Na+2H2O=2NaOH+H2↑表示出氧气、氢气的物质的量,再根据所收集的气体在一定条件下恰好完全反应可知:n(H2)=2n(O2),据此列式计算出钠和过氧化钠的物质的量,再根据质量守恒计算出氢氧化钠的物质的量,最后根据c=$\frac{n}{V}$计算出所得溶液的物质的量浓度.
解答 解:为证明过氧化钠可作供氧剂,实验中需要的反应物是二氧化碳和过氧化钠,根据题中装置可知,A是二氧化碳气体的制备装置,实验室用碳酸钙和稀盐酸制二氧化碳,制得的二氧化碳中含氯化氢气体,B是二氧化碳的净化装置,用饱和碳酸氢钠溶液除去氯化氢,在C中放置过氧钠固体与二氧化碳反应产生氧气,F是收集氧气的装置,最后对F收集到的气体进行检验,检验氧气前需除掉混在氧气中的二氧化碳,用D装置氢氧化钠溶液吸收,
(1)仪器a是分液漏斗,
故答案为:分液漏斗;
(2)碳酸钙与盐酸反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑,离子方程式为:CaCO3+2H+═CO2↑+H2O+Ca2+,
故答案为:CaCO3+2H+═CO2↑+H2O+Ca2+;
(3)C中装有过氧化钠,HCl与过氧化钠要发生反应,饱和碳酸氢钠溶液可除去CO2中的HCl气体,二氧化碳与过氧化钠反应生成碳酸钠和氧气,从C装置出来的气体中为氧气和未反应的二氧化碳,用盛有氢氧化钠溶液的D装置除去二氧化碳;
故答案为:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 除去CO2中的HCl气体 | |
| D | 氢氧化钠溶液 | 除去氧气中的CO2 |
故答案为:2Na2O2+2CO2═2Na2CO3+O2 ;
(5)设Na2O2、Na的物质的量分别为x mol、y mol,根据质量可得:①78x+23y=12.4,
所收集的气体在一定条件下恰好完全反应,说明反应生成气体物质的量满足:n(H2)=2n(O2),
根据方程式2Na2O2+2H2O=4NaOH+O2↑、2Na+2H2O=2NaOH+H2↑可知,n(H2)=$\frac{1}{2}$y=2n(O2)=2×$\frac{1}{2}$x,即:②x=$\frac{1}{2}$y,
根据①②联立解得:x=0.1、y=0.2,
反应后溶液中溶质为NaOH,根据Na元素质量守恒可知氢氧化钠的物质的量为:0.1mol×2+0.2mol=0.4mol,
所得溶液中氢氧化钠的物质的量浓度为:$\frac{0.4mol}{0.1L}$=4mol/L,
故答案为:4.
点评 本题以实验为载体考查了化学方程式的书写,明确物质的性质,并注意质量守恒在化学计算中的应用,试题培养了学生的分析能力及灵活应用基础知识的能力.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案| A. | 原子半径的大小顺序为:rX>rY>rZ>rW>rQ | |
| B. | Z和Q形成的化合物为离子化合物 | |
| C. | 不存在由元素Z与元素W形成的化合物的水溶液 | |
| D. | 元素W的最高价氧化物对应的水化物的酸性比Q的强 |
| A. | 0.80 | B. | 0.85 | C. | 0.90 | D. | 0.93 |
 系统命名:3,3-二甲基-1-丁炔.
系统命名:3,3-二甲基-1-丁炔. 、
、 、
、 ;C6H5OCH3.
;C6H5OCH3.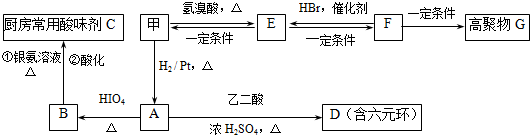
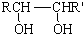 $→_{△}^{HIO_{4}}$ RCHO+R′CHO
$→_{△}^{HIO_{4}}$ RCHO+R′CHO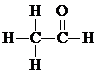 .
.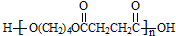 .
.