题目内容
完成下列反应的方程式
(1)H2O2与Fe2+在酸性条件下反应:
(2)NaClO在碱性条件下与Fe3+反应得到FeO42-:
(3)NaClO溶液将Mn2+氧化为难溶于水的MnO2: .
(1)H2O2与Fe2+在酸性条件下反应:
(2)NaClO在碱性条件下与Fe3+反应得到FeO42-:
(3)NaClO溶液将Mn2+氧化为难溶于水的MnO2:
考点:离子方程式的书写
专题:离子反应专题
分析:(1)H2O2与Fe2+在酸性条件下反应生成铁离子和水;
(2)NaClO在碱性条件下与Fe3+反应得到FeO42-,依据氧化还原反应电子守恒配平书写;
(3)NaClO溶液将Mn2+氧化为难溶于水的MnO2,本身被还原为氯离子.
(2)NaClO在碱性条件下与Fe3+反应得到FeO42-,依据氧化还原反应电子守恒配平书写;
(3)NaClO溶液将Mn2+氧化为难溶于水的MnO2,本身被还原为氯离子.
解答:
解:(1)H2O2与Fe2+在酸性条件下反应生成铁离子和水,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)NaClO在碱性条件下与Fe3+反应得到FeO42-,依据氧化还原反应电子守恒配平书写得到,2Fe3++10OH-+3ClO-=2FeO42-+9Cl-+5H2O,
故答案为:2Fe3++10OH-+3ClO-=2FeO42-+9Cl-+5H2O;
(3)NaClO溶液将Mn2+氧化为难溶于水的MnO2,本身被还原为氯离子,反应的离子方程式为:ClO-+Mn2++2OH-=MnO2+Cl-+H2O,
故答案为:ClO-+Mn2++2OH-=MnO2+Cl-+H2O.
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(2)NaClO在碱性条件下与Fe3+反应得到FeO42-,依据氧化还原反应电子守恒配平书写得到,2Fe3++10OH-+3ClO-=2FeO42-+9Cl-+5H2O,
故答案为:2Fe3++10OH-+3ClO-=2FeO42-+9Cl-+5H2O;
(3)NaClO溶液将Mn2+氧化为难溶于水的MnO2,本身被还原为氯离子,反应的离子方程式为:ClO-+Mn2++2OH-=MnO2+Cl-+H2O,
故答案为:ClO-+Mn2++2OH-=MnO2+Cl-+H2O.
点评:本题考查了离子方程式书写方法和注意问题,注意氧化还原反应电子守恒和电荷守恒的分析应用,题目较简单.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
下列有关工业生产叙述正确的是( )
| A、电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小 |
| B、合成氨工业中,将NH3及时液化分离有利于加快反应速率 |
| C、硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 |
| D、侯氏制碱是将CO2和NH3先后通入饱和氯化钠溶液中得碳酸氢钠固体,再灼烧制碳酸钠固体 |
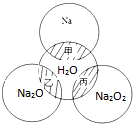 如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )
如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )| A、甲乙丙反应都属于氧化还原反应 |
| B、丙反应中的氧化剂是Na2O2,还原剂是H20 |
| C、丙反应中若消耗1molNa2O2,则转移2moL的电子 |
| D、甲乙丙反应后所得溶液的质量分数分别为ω1、ω2、ω3,则2ω1>ω2=ω3 |
下列有关实验原理或实验操作结论正确的是( )
| A、配制酸性KMnO4溶液时,用盐酸酸化 |
| B、用水湿润pH试纸测量某溶液的pH值 |
C、实验室用右图所示装置除去Cl2中的少量HCl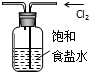 |
| D、用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |