题目内容
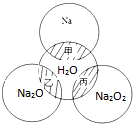 如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )
如图所示,两圆圈相交的阴影部分甲乙丙表示圆圈内物质相互发生反应,钠及其氧化物的物质的量均为0.1mol.水的质量为100g,下列说法正确的是( )| A、甲乙丙反应都属于氧化还原反应 |
| B、丙反应中的氧化剂是Na2O2,还原剂是H20 |
| C、丙反应中若消耗1molNa2O2,则转移2moL的电子 |
| D、甲乙丙反应后所得溶液的质量分数分别为ω1、ω2、ω3,则2ω1>ω2=ω3 |
考点:钠的重要化合物
专题:元素及其化合物
分析:A.根据反应中是否有元素化合价的变化判断;
B.Na2O2与水反应时,自身发生氧化还原反应;
C.根据过氧化钠和水反应的方程式中O元素的化合价变化计算;
D.根据固体的物质的量计算溶液中溶质的质量、溶液的质量,根据质量分数公式判断质量分数相对大小.
B.Na2O2与水反应时,自身发生氧化还原反应;
C.根据过氧化钠和水反应的方程式中O元素的化合价变化计算;
D.根据固体的物质的量计算溶液中溶质的质量、溶液的质量,根据质量分数公式判断质量分数相对大小.
解答:
解:A.反应中存在元素化合价的变化的反应属于氧化还原反应,甲、丙属于氧化还原反应,乙中没有元素化合价的变化,则乙不是氧化还原反应,故A错误;
B.丙反应2Na2O2+2H2O=4NaOH+O2↑中Na2O2既得电子又失电子,则Na2O2既是氧化剂又是还原剂,故B错误;
C.丙中反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,消耗1molNa2O2,则转移1mol电子,故C错误;
D.钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+
H2↑,溶液增加的质量=m(Na)-m(H2)=2.3g-0.1g=2.2g;
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+
O2↑,溶液增加的质量=m(Na2O2)-m(O2)=m(Na2O)=6.2g
所以溶液增加的质量大小顺序为:钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠分别溶于水所得溶液的质量分数分别为:w1=
、w2=
、w3=
,则:2w1>w2=w3,故D正确.
故选D.
B.丙反应2Na2O2+2H2O=4NaOH+O2↑中Na2O2既得电子又失电子,则Na2O2既是氧化剂又是还原剂,故B错误;
C.丙中反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,消耗1molNa2O2,则转移1mol电子,故C错误;
D.钠、氧化钠、过氧化钠和水反应的方程式分别如下:
Na+H2O=NaOH+
| 1 |
| 2 |
Na2O+H2O=2NaOH,溶液增加的质量=m(Na2O)=0.1mol×62g/mol=6.2g;
Na2O2+H2O=2NaOH+
| 1 |
| 2 |
所以溶液增加的质量大小顺序为:钠<氧化钠=过氧化钠,
根据钠原子守恒知,0.1mol的钠、氧化钠、过氧化钠、溶于水所得氢氧化钠的物质的量分别为:0.1mol、0.2mol、0.2mol,通过以上分析可知,0.1mol的钠、氧化钠、过氧化钠分别溶于水所得溶液的质量分数分别为:w1=
| 4g |
| 100g+2.2g |
| 8g |
| 100g+6.2g |
| 8g |
| 100g+6.2g |
故选D.
点评:本题考查了钠及其化合物的性质,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握溶液中溶质质量分数的计算方法,注意知识的归纳和整理以及灵活应用是关键,题目难度中等.

练习册系列答案
相关题目
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.3mol/L |
| B、Y2为0.4mol/L |
| C、X2为0.2mol/L |
| D、Z为0.4mol/L |
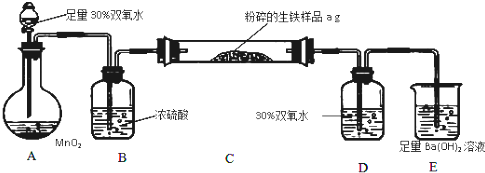


 RO-CH2-OR
RO-CH2-OR
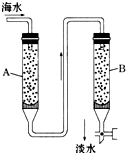 随着现代科学的不断发展,生产和生活所需淡水日益增多,甚至超过人类所能支配的淡水量,使地球上淡水资源发生危机,这就把海水淡化问题提到了科学家的面前.磺化媒(代表式NaR)是一种钠型离子交换树脂,它能使海水中的Ca2+、Mg2+交换除去.
随着现代科学的不断发展,生产和生活所需淡水日益增多,甚至超过人类所能支配的淡水量,使地球上淡水资源发生危机,这就把海水淡化问题提到了科学家的面前.磺化媒(代表式NaR)是一种钠型离子交换树脂,它能使海水中的Ca2+、Mg2+交换除去.