题目内容
X、Y、Z、L、M、N是六种原子序数依次增大的前四周期元素.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.N的核电荷数比L的核电荷数的3倍多2,回答下列问题:
(1)X和Y可以形成10电子、14电子、18电子分子,写出X元素质子数和中子数相等的核素的符号 .由X和Y元素组成的14电子分子的电子式为 .
(2)在水溶液中Z2H5+将Fe3+还原为Fe2+,Z2H5++4Fe3+→4Fe2++…其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为 .
(3)一定条件下,M与TiO2、C(石墨)反应只生成M的氧化物和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知.该反应生成lmol M的氧化物时放出536kJ的热量,其热化学方程式为 .
(4)Z元素的气态氢化物和最高价氧化物对应的水化物化合生成一种盐,该盐的水溶液呈 (填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序 .
(5)N的低价硫酸盐溶液与过氧化钠反应.若N的低价硫酸盐与过氧化钠的物质的量之比为2:1,且无气体生成,则该反应的离子方程式为 .且无气体生成,则该反应的离子方程式为 .
(1)X和Y可以形成10电子、14电子、18电子分子,写出X元素质子数和中子数相等的核素的符号
(2)在水溶液中Z2H5+将Fe3+还原为Fe2+,Z2H5++4Fe3+→4Fe2++…其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为
(3)一定条件下,M与TiO2、C(石墨)反应只生成M的氧化物和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知.该反应生成lmol M的氧化物时放出536kJ的热量,其热化学方程式为
(4)Z元素的气态氢化物和最高价氧化物对应的水化物化合生成一种盐,该盐的水溶液呈
(5)N的低价硫酸盐溶液与过氧化钠反应.若N的低价硫酸盐与过氧化钠的物质的量之比为2:1,且无气体生成,则该反应的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:M是地壳中含量最高的金属元素,所以M是Al,X、Y、Z、L是组成蛋白质的基础元素,且X、Y、Z、L、M五种元素的原子序数依次增大,所以X、Y、Z、L分别是H、C、N、O,N的核电荷数比L的核电荷数的3倍多2则为铁,据此答题.
解答:
解:M是地壳中含量最高的金属元素,所以M是Al,X、Y、Z、L是组成蛋白质的基础元素,且X、Y、Z、L、M五种元素的原子序数依次增大,所以X、Y、Z、L分别是H、C、N、O.N的核电荷数比L的核电荷数的3倍多2则为铁,
(1)X元素质子数和中子数相等的核素的符号12H,由X和Y元素组成的14电子分子为乙炔,它的电子式为 ,
,
故答案为:12H; ;
;
(2)在水溶液中N2H5+将Fe3+还原为Fe2+,N2H5++4Fe3+→4Fe2++,根据氧化还原原理可知该反应的离子方程式为N2H5++4Fe3+=4Fe2++N2+5H+,
故答案为:N2H5++4Fe3+=4Fe2++N2+5H+;
(3)根据题意和热化学方程式的书写步骤可知得4Al(s)+3TiO2(s)+3C(s)=2Al 2O3(s)+TiC(s)△H=-1072kJ?mol-1,
故答案为:4Al(s)+3TiO2(s)+3C(s)=2Al 2O3(s)+TiC(s)△H=-1072kJ?mol-1;
(4)硝酸铵是强酸弱碱盐水解呈酸性,离子浓度大小关系为[OH-]<[H+]<[NH4+]<[NO3-],
故答案为:[酸:OH-]<[H+]<[NH4+]<[NO3-];
(5)过氧化钠做氧化剂,二价铁离子做还原剂,根据氧化还原反应原理可写出方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+2Fe3++6Na+,
故答案为:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+2Fe3++6Na+.
(1)X元素质子数和中子数相等的核素的符号12H,由X和Y元素组成的14电子分子为乙炔,它的电子式为
 ,
,故答案为:12H;
 ;
;(2)在水溶液中N2H5+将Fe3+还原为Fe2+,N2H5++4Fe3+→4Fe2++,根据氧化还原原理可知该反应的离子方程式为N2H5++4Fe3+=4Fe2++N2+5H+,
故答案为:N2H5++4Fe3+=4Fe2++N2+5H+;
(3)根据题意和热化学方程式的书写步骤可知得4Al(s)+3TiO2(s)+3C(s)=2Al 2O3(s)+TiC(s)△H=-1072kJ?mol-1,
故答案为:4Al(s)+3TiO2(s)+3C(s)=2Al 2O3(s)+TiC(s)△H=-1072kJ?mol-1;
(4)硝酸铵是强酸弱碱盐水解呈酸性,离子浓度大小关系为[OH-]<[H+]<[NH4+]<[NO3-],
故答案为:[酸:OH-]<[H+]<[NH4+]<[NO3-];
(5)过氧化钠做氧化剂,二价铁离子做还原剂,根据氧化还原反应原理可写出方程式为3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+2Fe3++6Na+,
故答案为:3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+2Fe3++6Na+.
点评:本题是一道关于元素周期表和元素周期律知识的综合题目,考查角度广,内容多,难度较大,解题的关键在于元素推断.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
(NH4)2Cr2O7是一种受热易分解的盐,在分解的过程中发生了氧化还原反应.下列各组对(NH4)2Cr2O7受热分解产物的判断,符合实际的是( )
| A、CrO3+NH3+H2O |
| B、Cr2O3+NH3+H2O |
| C、CrO3+N2+H2O |
| D、Cr2O3+N2+H2O |
下列化学反应属于吸热反应的是( )
| A、碘的升华 |
| B、生石灰溶于水 |
| C、氢氧化钠溶液与稀盐酸反应 |
| D、熟石灰与NH4Cl晶体混合制氨 |
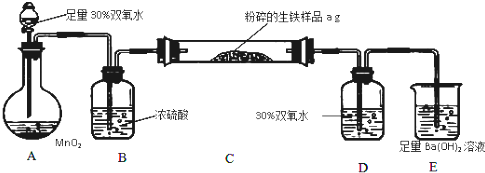


 RO-CH2-OR
RO-CH2-OR 已知1,2二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2二氯乙烷的消去反应,设计了如下实验装置.请回答下列问题.
已知1,2二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2二氯乙烷的消去反应,设计了如下实验装置.请回答下列问题.