题目内容
某小型化工厂生产皓矾(ZnSO4?7H2O)的工艺流程如图所示:已知:开始生成氢氧化物沉淀到沉淀完全的pH范围分别为Fe(OH)3:2.7~3.7;Fe(OH)2:7.6~9.6;Zn(OH)2:5.7~8.0.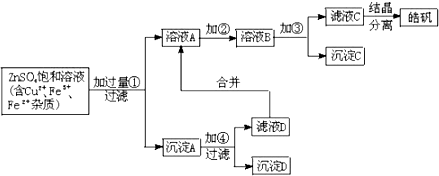
试回答下列问题:
(1)加入的试剂①应是 ,其目的是 .
(2)加入的试剂②,供选择使用的有:氯水、NaClO溶液、20% H2O2溶液、浓硫酸、浓硝酸等,应选用 ,其理由是 .
(3)加入的试剂③是 ,目的是 .

试回答下列问题:
(1)加入的试剂①应是
(2)加入的试剂②,供选择使用的有:氯水、NaClO溶液、20% H2O2溶液、浓硫酸、浓硝酸等,应选用
(3)加入的试剂③是
考点:制备实验方案的设计,物质分离、提纯的实验方案设计
专题:实验设计题
分析:由制备流程可知,在①中加入过量的铁粉,发生反应:Fe+2Fe3+=3Fe2+和Fe+Cu2+=Fe2++Cu,过滤,除去铜和剩余的铁粉,则溶液A中含有的金属离子是Fe2+和Zn2+.由信息中金属离子转化为沉淀的pH可知,需先将Fe2+氧化为Fe3+,然后再将Fe3+转化为Fe(OH)3沉淀除去,在选择氧化剂时,既要能氧化Fe2+又不引入新的杂质,不宜选用Cl2、KMnO4、HNO3等氧化剂,加入的试剂②为双氧水(H2O2的水溶液)最适宜.只要调整溶液的pH在2.7~5.7的范围内,Fe3+可以完全沉淀而除去,Zn2+不会沉淀,加入的试剂③可以是ZnCO3,能控制pH在5.7附近,且不引入杂质离子,则滤液成为硫酸锌,蒸发浓缩,冷却后进行结晶得到皓矾.沉淀A中含Fe、Cu,则加④为稀硫酸,沉淀D为Cu,滤液D含硫酸亚铁与滤液A合并,以此来解答.
解答:
解:由制备流程可知,在①中加入过量的铁粉,发生反应:Fe+2Fe3+=3Fe2+和Fe+Cu2+=Fe2++Cu,过滤,除去铜和剩余的铁粉,则溶液A中含有的金属离子是Fe2+和Zn2+.由信息中金属离子转化为沉淀的pH可知,需先将Fe2+氧化为Fe3+,然后再将Fe3+转化为Fe(OH)3沉淀除去,在选择氧化剂时,既要能氧化Fe2+又不引入新的杂质,不宜选用Cl2、KMnO4、HNO3等氧化剂,加入的试剂②为双氧水(H2O2的水溶液)最适宜.只要调整溶液的pH在2.7~5.7的范围内,Fe3+可以完全沉淀而除去,Zn2+不会沉淀,加入的试剂③可以是ZnCO3,能控制pH在5.7附近,且不引入杂质离子,则滤液成为硫酸锌,蒸发浓缩,冷却后进行结晶得到皓矾.沉淀A中含Fe、Cu,则加④为稀硫酸,沉淀D为Cu,滤液D含硫酸亚铁与滤液A合并,
(1)加入的试剂①应是Fe,目的是除去铜离子,故答案为:Fe;除去铜离子;
(2)由上述制备流程可知,需先将Fe2+氧化为Fe3+,然后再将Fe3+转化为Fe(OH)3沉淀除去,在选择氧化剂时,既要能氧化Fe2+又不引入新的杂质,不宜选用氯水、NaClO溶液、浓硫酸、浓硝酸等氧化剂,加入的试剂②为双氧水(H2O2的水溶液)最适宜,
故答案为:20% H2O2溶液; 将Fe2+氧化成Fe3+;
(3)只要调整溶液的pH在2.7~5.7的范围内,Fe3+可以完全沉淀而除去,Zn2+不会沉淀,加入的试剂③是ZnCO3,能控制pH在5.7附近,且不引入杂质离子,
故答案为:ZnCO3; 能控制pH在5.7附近,且不引入杂质离子.
(1)加入的试剂①应是Fe,目的是除去铜离子,故答案为:Fe;除去铜离子;
(2)由上述制备流程可知,需先将Fe2+氧化为Fe3+,然后再将Fe3+转化为Fe(OH)3沉淀除去,在选择氧化剂时,既要能氧化Fe2+又不引入新的杂质,不宜选用氯水、NaClO溶液、浓硫酸、浓硝酸等氧化剂,加入的试剂②为双氧水(H2O2的水溶液)最适宜,
故答案为:20% H2O2溶液; 将Fe2+氧化成Fe3+;
(3)只要调整溶液的pH在2.7~5.7的范围内,Fe3+可以完全沉淀而除去,Zn2+不会沉淀,加入的试剂③是ZnCO3,能控制pH在5.7附近,且不引入杂质离子,
故答案为:ZnCO3; 能控制pH在5.7附近,且不引入杂质离子.
点评:本题考查制备实验方案的设计,为高频考点,把握流程中的反应及混合物分离方法为解答的关键,侧重分析、实验能力的综合考查,题目难度中等.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
下列过程一定不能自发进行的是( )
| A、4NO2(g)+O2(g)=2N2O5(g);△H<0 |
| B、2CO(g)=2C(s)+O2(g);△H>0 |
| C、(NH4)2CO3(s)=NH4HCO3(s)+NH3(g);△H>0 |
| D、2H2(g)+O2(g)=2H2O(l);△H<0 |
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.3mol/L |
| B、Y2为0.4mol/L |
| C、X2为0.2mol/L |
| D、Z为0.4mol/L |

 如图所示是实验进行石油蒸馏的装置,请回答下列问题
如图所示是实验进行石油蒸馏的装置,请回答下列问题