题目内容
4.可以描述两种一元酸:甲( Ki=1.8×10-5)和乙( Ki=1.4×10-3)在水中的电离度与浓度关系的曲线是( )| A. |  | B. |  | C. |  | D. |  |
分析 由甲(Ka=1.8×10-5)和乙(Ka=1.4×10-3)可知,甲的Ka小,则甲的酸性弱;等浓度时酸性强的电离度大;弱酸的浓度越大,其电离度越小,以此来解答.
解答 解:两种一元酸:甲(Ka=1.8×10-5)和乙(Ka=1.4×10-3)可知,甲的Ka小,则甲的酸性弱;
由图可知,横坐标为浓度,纵坐标为电离度,则等浓度时酸性强的电离度大,即乙的曲线在上方,可排除A、C;
弱酸的浓度越大,其电离度越小,则曲线甲、乙均随浓度的增大而下降,可排除D,显然只有B符合,
故选B.
点评 本题考查弱电解质的电离,把握Ka与酸性的关系、弱酸的电离度与浓度的关系及图象分析为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
7. H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )
H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )
 H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )
H2S利用是回收能量并得到单质硫.反应原理为:2H2S(g)+02(g)=S2(s)+2H20(1)△H=-632kJ•mol-1.图为质子膜H2S燃料电池示意图.下列说法正确的是( )| A. | 该电池可实现把化学能全部转化为电能 | |
| B. | 电极b上发生的电极反应为:02+2H2O+4e-=40H- | |
| C. | 电极a上发生的电极反应为:2H2S-4e-=S2+4H+ | |
| D. | 标况下,当有22.4LH2S参与反应时,有2mo1H+经质子膜进入负极区 |
8.含有的Cl-个数与3molNaCl含有的Cl-个数相同的物质是( )
| A. | 1molMgCl2 | B. | 3molKClO3 | C. | 1molAlCl3 | D. | 1.5molCaCl2 |
12.关于自发过程的叙述,正确的是( )
| A. | 其逆过程在相同条件下也必定是自发的 | |
| B. | 其逆过程在相同条件下也可能是自发的 | |
| C. | 其逆过程在其他条件下也可能是自发的 | |
| D. | 自发过程与外界条件无关 |
9.用0.1000mol•L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 | |
| B. | 应该选择酚酞作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
16.下列事实能说明醋酸是弱电解质的是( )
①醋酸与水以任意比例互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子④测得醋酸的pH比盐酸pH大
⑤在漂白剂溶液中滴加醋酸能增强漂白效果
⑥0.1mol/L醋酸溶液的pH=2
⑦CH3COOK溶液能使酚酞试液变红色
⑧大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生氢气速率慢.
①醋酸与水以任意比例互溶
②醋酸溶液能导电
③醋酸溶液中存在醋酸分子④测得醋酸的pH比盐酸pH大
⑤在漂白剂溶液中滴加醋酸能增强漂白效果
⑥0.1mol/L醋酸溶液的pH=2
⑦CH3COOK溶液能使酚酞试液变红色
⑧大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生氢气速率慢.
| A. | ①④⑥⑧ | B. | ②④⑥⑦ | C. | ④⑤⑥⑧ | D. | ③⑥⑦⑧ |
13.下面叙述正确的是( )
| A. | 蔗糖遇浓硫酸可发生碳化现象,但与稀硫酸则不会发生反应 | |
| B. | 因为纤维素结构中有羟基,所以它能与醋酸发生酯化反应,生成乙酸纤维素酯 | |
| C. | 除去淀粉中的葡萄糖杂质,可用加水渗析的方法 | |
| D. | 将淀粉与水在酸作用下加热水解,在滴入碘酒不变蓝时表示水解完全,即可停止加热 |
14.以下物质间的每步转化通过一步反应不能实现的是( )
| A. | S→SO3→H2SO4→SO2 | B. | N2→NO→NO2→HNO3 | ||
| C. | Na→Na2O→NaOH→Na2CO3 | D. | Al→Al2O3→Al2(SO4)3→Al(OH)3 |
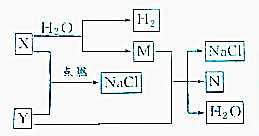 已知下列转化关系:
已知下列转化关系: