题目内容
(1)下表是第三周期部分元素氧化物和氟化物的熔点和摩氏硬度:
请回答下列问题
①基态硅原子的价电子排布式是 ,SiO2中硅原子的杂化轨道类型是 .
②请解释几种氟化物熔点差异的主要原因 .
③请解释MgF2和MgO摩氏硬度差异的主要原因 .
(2)等电子体CO与N2分子的结构式可分别表示为C≡O和N≡N.两者分子中有配位键的是 ;结合事实判断CO和N2相对更活泼的是 (填化学式),试用下表中的键能数据解释相对活泼的原因
(3)NO也具有一定的氧化性,且一般还原产物为N2,已知NO与P4在无氧条件下反应生成的氧化物中仅存在σ键,写出该反应方程式 .
(4)氢键的形成对物质的性质具有一定的影响.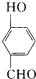 比
比 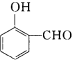 的沸点 .(填高或低)
的沸点 .(填高或低)
| 化合物 | NaF | MgF2 | MgO | SiF4 | SiO2 |
| 熔点/K | 1266 | 1534 | 3125 | 183 | 1983 |
| 摩氏硬度 | 3.2 | 6.0 | 6.5 | 7 |
①基态硅原子的价电子排布式是
②请解释几种氟化物熔点差异的主要原因
③请解释MgF2和MgO摩氏硬度差异的主要原因
(2)等电子体CO与N2分子的结构式可分别表示为C≡O和N≡N.两者分子中有配位键的是
| CO | C-O | C=O | C≡O | ||
键能(kJ?mol
| 357.7 | 798.9 | 1071.9 | ||
| N2 | N-N | N=N | N≡N | ||
键能(kJ?mol
| 154.8 | 418.4 | 941.7 |
(4)氢键的形成对物质的性质具有一定的影响.
 比
比  的沸点
的沸点考点:原子核外电子排布,配合物的成键情况,原子轨道杂化方式及杂化类型判断,氢键的存在对物质性质的影响
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)①Si元素14号元素,其3s、3p电子为其价电子,根据构造原理书写其价电子排布式;②二氧化硅晶体中,一个硅与四个氧相连,一个氧连接两个硅形成空间网状结构;②根据晶体类型不同,以及同种晶体类型影响微粒之间作用力的因素分析表中氟化物熔点差异的原因;
③因离子所带电荷影响离子晶体的晶格能;
(2)CO含配位键;根据提供的键能计算各物质中的第一个π键的键能,键能越大越稳定;
(3)根据题给信息,NO被还原为氮气,白磷被氧化成磷的氧化物,由于磷的氧化物中,磷仅存在σ键,故每个磷和氧形成3条共价键;每个氧形成两条共价键,所以4个磷结合6个氧形成氧化物;
(4)成分子间氢键熔沸点比形成分子内氢键的熔沸点更高.
③因离子所带电荷影响离子晶体的晶格能;
(2)CO含配位键;根据提供的键能计算各物质中的第一个π键的键能,键能越大越稳定;
(3)根据题给信息,NO被还原为氮气,白磷被氧化成磷的氧化物,由于磷的氧化物中,磷仅存在σ键,故每个磷和氧形成3条共价键;每个氧形成两条共价键,所以4个磷结合6个氧形成氧化物;
(4)成分子间氢键熔沸点比形成分子内氢键的熔沸点更高.
解答:
解:(1)Si元素14号元素,其3s、3p电子为其价电子,根据构造原理知其价电子排布式为3s23p2;故答案为:3s23p2;
二氧化硅晶体中,一个硅与四个氧相连,一个氧连接两个硅形成空间网状结构;故硅的4个价电子全部成键,价层电子对为4,为sp3杂化;故答案为:sp3;
②NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高;
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高;
③因为氧离子所带电荷多于氟离子,所以MgO晶体中离子的晶格能大于MgF2,故摩式硬度较大;
故答案为:因为O2-所带电荷多于F-,所以MgO晶体中离子的晶格能大于MgF2,故摩式硬度较大;
(2)根据氮气分子结构知,一个CO分子中含有3个共价键,氧最外层有6个电子,故和碳形成两条共价键可达8电子结构,现形成三条键,故含配位键,根据表中键能氮原子最外层有5个电子,形成3条共价键达稳定结构,不含配位键;
CO中第一个π键的键能是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,
N2中第一个π键的键能是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,
CO中第一个π键的键能是273kJ/mol,N2中第一个π键的键能是523.3kJ/mol,CO中第一个π键的键能较小,所以CO的第一个键比N2更容易断,所以一氧化碳比氮气活泼,
故答案为:CO;断裂CO分子的第一个π键所需的能量(1071.9kJ/mol-798.9kJ/mol=273kJ/mol),比断开N2的第一个化学键所需能量(941.7kJ/mol-418.4kJ/mol=523.3kJ/mol)小;
(3)根据题给信息,NO被还原为氮气,白磷被氧化成磷的氧化物,由于磷的氧化物中,磷仅存在σ键,故每个磷和氧形成3条共价键;每个氧形成两条共价键,所以4个磷结合6个氧形成氧化物,反应方程式为:6NO+P4=3N2+P4O6;故答案为:6NO+P4=3N2+P4O6;
(4)形成分子间氢键熔沸点比形成分子内氢键的熔沸点更高.由表中数据可知,间-羟基苯甲醛形成分子间氢键,邻-羟基苯甲醛形成分子内氢键,故前者沸点高;
故答案为:高.
二氧化硅晶体中,一个硅与四个氧相连,一个氧连接两个硅形成空间网状结构;故硅的4个价电子全部成键,价层电子对为4,为sp3杂化;故答案为:sp3;
②NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高;
故答案为:NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,Mg2+带2个单位正电荷数比Na+多,故MgF2的熔点比NaF高;
③因为氧离子所带电荷多于氟离子,所以MgO晶体中离子的晶格能大于MgF2,故摩式硬度较大;
故答案为:因为O2-所带电荷多于F-,所以MgO晶体中离子的晶格能大于MgF2,故摩式硬度较大;
(2)根据氮气分子结构知,一个CO分子中含有3个共价键,氧最外层有6个电子,故和碳形成两条共价键可达8电子结构,现形成三条键,故含配位键,根据表中键能氮原子最外层有5个电子,形成3条共价键达稳定结构,不含配位键;
CO中第一个π键的键能是1071.9kJ/mol-798.9kJ/mol=273kJ/mol,
N2中第一个π键的键能是941.7kJ/mol-418.4kJ/mol=523.3kJ/mol,
CO中第一个π键的键能是273kJ/mol,N2中第一个π键的键能是523.3kJ/mol,CO中第一个π键的键能较小,所以CO的第一个键比N2更容易断,所以一氧化碳比氮气活泼,
故答案为:CO;断裂CO分子的第一个π键所需的能量(1071.9kJ/mol-798.9kJ/mol=273kJ/mol),比断开N2的第一个化学键所需能量(941.7kJ/mol-418.4kJ/mol=523.3kJ/mol)小;
(3)根据题给信息,NO被还原为氮气,白磷被氧化成磷的氧化物,由于磷的氧化物中,磷仅存在σ键,故每个磷和氧形成3条共价键;每个氧形成两条共价键,所以4个磷结合6个氧形成氧化物,反应方程式为:6NO+P4=3N2+P4O6;故答案为:6NO+P4=3N2+P4O6;
(4)形成分子间氢键熔沸点比形成分子内氢键的熔沸点更高.由表中数据可知,间-羟基苯甲醛形成分子间氢键,邻-羟基苯甲醛形成分子内氢键,故前者沸点高;
故答案为:高.
点评:本题考查了物质结构和性质,难度较大,注意从晶体结构和分子结构考虑对物质性质的影响.

练习册系列答案
相关题目
将铜粉放入稀硫酸中,加热无明显现象发生.但加入某盐后,发现铜粉质量逐渐减少,则该盐可能是( )
| A、Fe2(SO4)3 |
| B、ZnSO4 |
| C、KNO3 |
| D、NaCl |
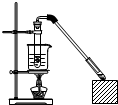 乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.
乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到小试管中溶液的液面上.