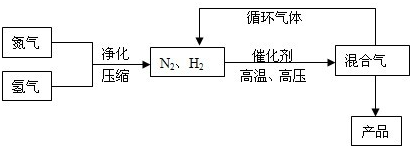
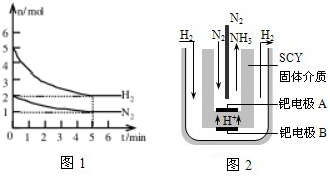
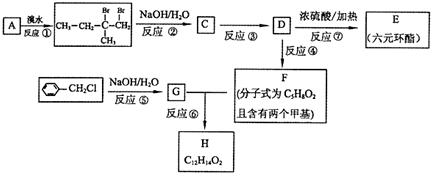
题目内容
铜(Cu)是重要金属,铜的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等.请回答以下问题:
(1)向CuSO4浓溶液中滴入浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液.再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4?H2O晶体.
①沉淀溶解的离子方程式为 .
②乙醇的作用是 .
③[Cu(NH3)4]2+具有对称的立体构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的立体构型为 ,其中N原子的杂化轨道类型是 .
(2)金(Au)与铜为同族元素,铜与金可形成具有储氢功能的合金.
①合金中,原子间的作用力是 .已知Au为第六周期元素,则基态Au原子的价电子排布式为 ,Au的原子序数为 .
②该储氢合金为立方最密堆积结构,晶胞中Cu原子位于面心、Au原子位于顶点,储氢时,H原子进入由Cu原子与Au原子构成的四面体空隙中,则该晶体储氢后的化学式为 .
(1)向CuSO4浓溶液中滴入浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液.再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4?H2O晶体.
①沉淀溶解的离子方程式为
②乙醇的作用是
③[Cu(NH3)4]2+具有对称的立体构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的立体构型为
(2)金(Au)与铜为同族元素,铜与金可形成具有储氢功能的合金.
①合金中,原子间的作用力是
②该储氢合金为立方最密堆积结构,晶胞中Cu原子位于面心、Au原子位于顶点,储氢时,H原子进入由Cu原子与Au原子构成的四面体空隙中,则该晶体储氢后的化学式为
考点:铜金属及其重要化合物的主要性质,配合物的成键情况,晶胞的计算
专题:化学键与晶体结构,元素及其化合物
分析:(1)①依据银铵溶液的制取原理书写氢氧化铜溶剂的离子方程式即可;
②乙醇与水以任意比混溶,利用的是乙醇可以降低溶剂的极性;
③依据[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,即邻边结构和对角线结构回答即可;
(2)①依据金属晶体类型判断化学键,依据Au的位置确定价电子排布以及原子序数;
②依据题意分别计算即可得出结果.
②乙醇与水以任意比混溶,利用的是乙醇可以降低溶剂的极性;
③依据[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,即邻边结构和对角线结构回答即可;
(2)①依据金属晶体类型判断化学键,依据Au的位置确定价电子排布以及原子序数;
②依据题意分别计算即可得出结果.
解答:
解:(1)①向硫酸铜中加入氨水,得到的是氢氧化铜沉淀,故溶解氢氧化铜的原理与制取银铵溶液相似,故反应的离子方程式为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-,故答案为:Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
②由于乙醇能与水以任意比例混溶,故加入乙醇可以减小溶剂的极性,降低离子化合物Cu(NH3)4SO4?H2O的溶解度,故答案为:减小溶剂的极性,降低离子化合物Cu(NH3)4SO4?H2O的溶解度;
③由于[Cu(NH3)4]2+具有对称的立体构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,类比甲烷为正四面体结构,其二氯代物只有一种,那么[Cu(NH3)4]2+的立体构型为平面正方形,即存在邻边二氯取代物和对角线二氯取代物,故答案为:平面正方形;N原子结合3个氢,余下一个空轨道,故其杂化方式为sp3,故答案为;sp3;
(2)①金属晶体或者是合金中存在的化学键类型是金属键,故答案为金属键;Au位于第六周期,第ⅠB副族,故其价电子排布式为:5d106s1,故答案为;5d106s1;由此推断其原子序数是79,故答案为:79;
②因为该储氢合金为立方最密堆积结构,晶胞中Cu原子位于面心,其个数为6×
=3、Au原子位于顶点,其个数为:8×
=1,储氢时,H原子进入由Cu原子与Au原子构成的四面体空隙中,其个数为8,则该晶体储氢后的化学式为H8AuCu3,故答案为:H8AuCu3.
②由于乙醇能与水以任意比例混溶,故加入乙醇可以减小溶剂的极性,降低离子化合物Cu(NH3)4SO4?H2O的溶解度,故答案为:减小溶剂的极性,降低离子化合物Cu(NH3)4SO4?H2O的溶解度;
③由于[Cu(NH3)4]2+具有对称的立体构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,类比甲烷为正四面体结构,其二氯代物只有一种,那么[Cu(NH3)4]2+的立体构型为平面正方形,即存在邻边二氯取代物和对角线二氯取代物,故答案为:平面正方形;N原子结合3个氢,余下一个空轨道,故其杂化方式为sp3,故答案为;sp3;
(2)①金属晶体或者是合金中存在的化学键类型是金属键,故答案为金属键;Au位于第六周期,第ⅠB副族,故其价电子排布式为:5d106s1,故答案为;5d106s1;由此推断其原子序数是79,故答案为:79;
②因为该储氢合金为立方最密堆积结构,晶胞中Cu原子位于面心,其个数为6×
| 1 |
| 2 |
| 1 |
| 8 |
点评:本题主要考查的是离子反应方程式的书写、杂化类型的判定、原子序数的推断等,属于综合题,有一定难度.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
下列化学用语表达正确的是( )
| A、溴化钙的化学式是CaBr |
B、HCl分子的电子式 |
| C、乙烯的结构简式:CH2CH2 |
D、氯原子的结构示意图: |
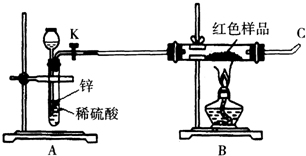
 用如图所示的装置制取乙酸乙酯.回答下列问题:
用如图所示的装置制取乙酸乙酯.回答下列问题: