题目内容
1.下表是周期表中的一部分,根据A~I在周期表中的位置,用元素符号或化学式回答下列问题:| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | B | ||||||
| 2 | D | E | F | G | ||||
| 3 | C | H | I |
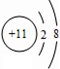 ,I的原子结构示意图
,I的原子结构示意图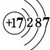 .
.(2)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为
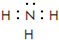 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).(3)元素的最高价氧化物对应的水化物中,碱性最强的是NaOH,该碱化学键类型离子键和共价键,酸性最强的是HClO4,呈两性的是Al(OH)3.
(4)A分别与D、E、F、G H形成的化合物的稳定性顺序为:CH4<NH3<H2O<HF.
分析 由A~I在周期表中的位置可知,A~I分别为H、He、Na、C、N、O、F、Si、Cl,
(1)Na离子的原子核外电子为10;Cl的质子数为17;
(2)A与E可形成一种极易溶于水的气态化合物为氨气;
(3)元素的最高价氧化物对应的水化物中,NaOH碱性最强,高氯酸酸性最强,氢氧化铝具有两性;
(4)非金属性越强,氢化物越稳定.
解答 解:由A~I在周期表中的位置可知,A~I分别为H、He、Na、C、N、O、F、Si、Cl,
(1)Na离子的原子核外电子为10,离子结构示意图为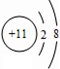 ;Cl的质子数为17,原子结构示意图为
;Cl的质子数为17,原子结构示意图为 ,
,
故答案为: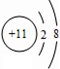 ;
; ;
;
(2)A与E可形成一种极易溶于水的气态化合物为氨气,其电子式为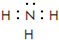 ,水溶液为氨水,显碱性,
,水溶液为氨水,显碱性,
故答案为: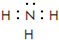 ;碱;
;碱;
(3)元素的最高价氧化物对应的水化物中,碱性最强的是NaOH,该碱化学键类型离子键和极性共价,酸性最强的是HClO4,呈两性的是Al(OH)3,
故答案为:NaOH;离子键和极性共价;HClO4;Al(OH)3;
(4)非金属性越强,氢化物越稳定,则稳定性顺序为CH4<NH3<H2O<HF,故答案为:CH4<NH3<H2O<HF.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究.已知:碱式碳酸钴受热时可分解生成三种氧化物.

(1)按如图所示装置组装好仪器,并检验装置的气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:

已知:25℃时
①净化除杂时,加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2--3的目的为抑制CoCl2的水解.

(1)按如图所示装置组装好仪器,并检验装置的气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:

已知:25℃时
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2--3的目的为抑制CoCl2的水解.
6.下表是元素周期表的一部分,针对表中的①~=10 ⑩种元素,填写下列空白:
(1)写出下列元素的名称⑧氩⑩钙
(2)在①~⑩元素中,金属性最强的元素是K(填元素符号),气态氢化物能与其最高价氧化物对应的水化物发生反应生成盐的元素是N(填元素符号).
(3)元素⑥与元素⑦相比,⑦的非金属性较强,下列表述中能证明这一事实的是bd.
a.常温下⑥的单质和⑦的单质状态不同
b.⑦的氢化物比⑥的氢化物稳定
c.一定条件下⑥和⑦的单质都能与氢氧化钠溶液反应
d.一定条件下⑥和⑦的单质与Fe反应的产物不同
(4)⑤的单质可以与⑨的最高价氧化物的水化物的溶液反应,若将该反应设计成原电池,其负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O.
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 第2周期 | ① | ② | ③ | |||||
| 第3周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第4周期 | ⑨ | ⑩ |
(2)在①~⑩元素中,金属性最强的元素是K(填元素符号),气态氢化物能与其最高价氧化物对应的水化物发生反应生成盐的元素是N(填元素符号).
(3)元素⑥与元素⑦相比,⑦的非金属性较强,下列表述中能证明这一事实的是bd.
a.常温下⑥的单质和⑦的单质状态不同
b.⑦的氢化物比⑥的氢化物稳定
c.一定条件下⑥和⑦的单质都能与氢氧化钠溶液反应
d.一定条件下⑥和⑦的单质与Fe反应的产物不同
(4)⑤的单质可以与⑨的最高价氧化物的水化物的溶液反应,若将该反应设计成原电池,其负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O.
10.下列离子方程式正确的是( )
| A. | Cl2与H2O反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 往FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+ | |
| C. | 向AlCl3溶液中滴加氨水至过量:Al3++3OH-═Al(OH)3↓ | |
| D. | 将铜片投入浓硝酸中:2NO3-+Cu+4H+═Cu2++2NO2↑+2H2O |
11.已知:Na2O2+CO2→Na2CO3+O2(未配平),关于该反应的说法中正确的是( )
| A. | 生成0.1 mol O2转移0.4mol电子 | |
| B. | 相同条件下足量Na2O2吸收10LCO2放出5LCO2 | |
| C. | 氧化剂是Na2O2,还原剂是CO2 | |
| D. | 在Na2O2+SO2═Na2SO4的反应中,SO2的作用跟CO2相同 |



 .
.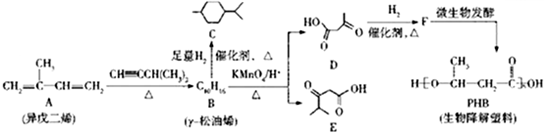
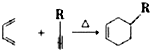
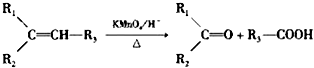
 .反应类型为加成反应或还原反应.
.反应类型为加成反应或还原反应.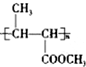 的合成路线
的合成路线 .
.