题目内容
15.下列变化过程需要吸收能量的是( )| A. | 甲烷的燃烧 | B. | H2→H+H | C. | 酸碱中和反应 | D. | CaO+H2O=Ca(OH)2 |
分析 过程一定吸热能量说明该反应是吸热反应,当反应物的能量低于生成物总能量时,反应是吸热反应,吸热反应是化学反应中反应物获得能量在生成物中储存的过程,常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱),化学键的断裂.
A.燃烧为放热反应;
B.断裂化学键吸收能量;
C.酸碱中和反应为放热反应;
D.活泼金属氧化物与水的反应为放热反应.
解答 解:A.甲烷燃烧为放热反应,故A错误;
B.断裂化学键吸收能量,H2→H+H要吸收能量,故B正确;
C.酸碱中和反应为放热反应,故C错误;
D.活泼金属氧化物与水的反应为放热反应,CaO+H2O=Ca(OH)2为放热反应,故D错误,
故选B.
点评 本题考查了化学反应的本质,化学键断裂吸热,化学键形成放热,燃烧反应,中和反应等分析应用,题目较简单.

练习册系列答案
相关题目
5.依据表25℃时某些弱酸的电离平衡常数,判断下列说法正确的是( )
| CH3COOH | HC1O | H2CO3 |
| Ka=1.8×l0-5 | Ka=3.0×l0-8 | Ka1=4.4×l0-7Ka2=4.7×l0-11 |
| A. | 向NaClO溶液中通入少量CO2的离子方程式为:2C1O-+CO2+H2O═2HC1O+CO32- | |
| B. | 相同浓度的CH3COOH和NaClO的混合溶液中,水的电离程度前者大 | |
| C. | 向0.lmol•L-l的CH3COOH溶液中滴加NaOH溶液至pH=5,此时溶液的 c(CH3COOH):c(CH3COO-)=5:9 | |
| D. | 常温下,0•lmol•L-1 的 NaHC2O4 溶液 pH=4:c(HC2O4-)>c(H+)>c(H2C2O4)>c(C2O42-) |
3.下列叙述正确的是( )
| A. | 离子化合物中可能含有共价键 | |
| B. | 化学键是分子间强烈的作用力 | |
| C. | H、D、T表示三种氢元素 | |
| D. | 共价化合物中各原子都一定满足最外层8电子稳定结构 |
20.下列化学用语表示正确的是( )
| A. | CO2的分子模型示意图: | |
| B. | 甲烷的电子式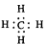 | |
| C. | 硫离子核外电子排布式1s22s22p63s23p4 | |
| D. | 中子数为8的碳原子86C |
4.乙醇转化为乙醛,发生的反应为( )
| A. | 取代反应 | B. | 加成反应 | C. | 消除反应 | D. | 氧化反应 |
20.X、Y、Z、R、W是原子序数依次增大的五种短周期元素.Y和R同主族,可组成共价化合物RY2,Y和Z最外层电子数之和与W的最外层电子数相同,25℃时,0.1mol/LX和W形成化合物的水溶液pH=1.下列说法正确的是( )
| A. | Z与Y、Z与W形成的化合物的化学键完全相同 | |
| B. | X与Y组成的简单氢化物的沸点高于X与R组成的简单氢化物的沸点,是因为非金属性Y>R | |
| C. | 简单离子的半径:Z>R>W>Y | |
| D. | Y、Z、W三种元素组成的化合物的水溶液可能显碱性 |
