题目内容
20.下列化学用语表示正确的是( )| A. | CO2的分子模型示意图: | |
| B. | 甲烷的电子式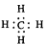 | |
| C. | 硫离子核外电子排布式1s22s22p63s23p4 | |
| D. | 中子数为8的碳原子86C |
分析 A、二氧化碳为直线型结构;
B、甲烷为共价化合物;
C、硫离子是硫原子得两个电子形成的;
D、质量数写在原子符号左上角,且质量数=质子数+中子数.
解答 解:A、二氧化碳为直线型结构,其正确的比例模型为: ,故A错误;
,故A错误;
B、甲烷为共价化合物,4个H原子分别与C原子形成4条共价键,故电子式为 ,故B正确;
,故B正确;
C、硫离子是硫原子得两个电子形成的,故最外层有8个电子,故核外电子排布式1s22s22p63s23p6,故C错误;
D、质量数写在原子符号左上角,且质量数=质子数+中子数,故中子数为8的碳原子的质量数为8+6=14,故符号为146C,故D错误.
故选B.
点评 本题考查了化学用语的判断,属于基础知识的考查,题目难度中等,注意掌握球棍模型和比例模型的区别以及表示方法,试题考查了学生规范答题的能力.

练习册系列答案
相关题目
10.常温下,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 CaCl2溶液等体积混合:c(Na+)+c(Ca2+)═c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 少量Cl2通入过量泠的0.1 mol•L-1 NaOH溶液中:c(Na+)═c(HClO)+c(ClO-)+c(Cl-) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1 HCl溶液混合至pH=7:c(Na+)>c(Cl-)═c(CH3COOH) | |
| D. | 0.2 mol•L-1 NH3•H2O溶液与0.1 mol•L-1 HCl溶液等体积混合:c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-) |
11.下列选项描述的过程中,能实现化学能转化为电能的是( )
| A. |  光合作用 | B. |  烧炭取暖 | C. |  风力发电 | D. |  电解冶炼 |
8.一定条件想,将X和Y气体通入1L密闭容器中,发生反应:aX(g)+bY(g)?mZ(g),5s内反应速率如下:v(X)=0.3mol•L-1•s-1,v(Y)=0.6mol•L-1•s-1,v(Z)=0.6mol•L-1•s-1,则a、b、m的值分别为( )
| A. | 1、3、2 | B. | 1、2、2 | C. | 1、3、3 | D. | 1、1、3 |
15.下列变化过程需要吸收能量的是( )
| A. | 甲烷的燃烧 | B. | H2→H+H | C. | 酸碱中和反应 | D. | CaO+H2O=Ca(OH)2 |
5.下列对一些实验事实及其理论解释都正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | Be原子的第一电离能小于B原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CH4为正四面体形分子 | CH4分子中C为sp3杂化,键角为109°28′ |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点高于HCl | HF分子间能形成氢键,HCl不能 |
| A. | A | B. | B | C. | C | D. | D |
12.在某元素的原子核外电子排布中,K电子层和L电子层的电子数之和等于M电子层和N电子层的电子数之和.则该元素的核电荷数为( )
| A. | 12 | B. | 17 | C. | 20 | D. | 30 |
9.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | Al2O3$\stackrel{盐酸}{→}$AlCl3溶液$\stackrel{通电}{→}$Al | |
| B. | NH3$→_{△}^{O_{2}/催化剂}$NO2$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | S$→_{点燃}^{O_{2}}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| D. | SiO2$\stackrel{NaOH溶液}{→}$Na2SiO3溶液$\stackrel{CO_{2}}{→}$H2SiO3 |
5.下列说法正确的是( )
| A. | 铜的化学性质比铁稳定,在铁闸上安装铜块可减慢铁闸的腐蚀速率 | |
| B. | 氢氧燃料电池正极消耗5.6 L气体时,电路中通过的电子数为6.02×1023个 | |
| C. | 若2NO(g)+2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H<0 | |
| D. | 相同条件下,100 mL pH=3的HA溶液与HB溶液分别与足量的锌反应,HB放出氢气较多,说明HB酸性比HA的弱 |