题目内容
3.下列叙述正确的是( )| A. | 离子化合物中可能含有共价键 | |
| B. | 化学键是分子间强烈的作用力 | |
| C. | H、D、T表示三种氢元素 | |
| D. | 共价化合物中各原子都一定满足最外层8电子稳定结构 |
分析 A.离子化合物中可以含共价键;
B、化学键为相邻原子间强烈的相互作用;
C.质子数相同、中子数不同的同种元素的不同原子互为同位素;
D.共价化合物中不一定各原子都满足最外层8电子稳定结构.
解答 解:A.离子化合物中可以含共价键,如NaOH中含有离子键、共价键,故A正确;
B、化学键为相邻原子间强烈的相互作用,而不是分子间,故B错误;
C.H、D、T表示氢的同位素,可以说成:H、D、T可以用来表示氢元素的三种不同原子,故C错误;
D.共价化合物中不一定各原子都满足最外层8电子稳定结构,如氢化物,故D错误;
故选A.
点评 本题考查较综合,为高频考点,易错选项是B,注意化学键的概念,是相邻原子之间强烈的相互作用力,为易错点.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
13.在生产和生活上应用的含氯消毒剂、漂白剂有多种,如HClO、NaClO、ClO2等.
(1)氯气是合成含氯消毒剂的原料.在催化剂、420℃的条件下,氧气与氯化氢气体反应可置换出氯气,利用表数据写出该反应的热化学方程式O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-133KJ/mol.
(2)氯气溶于水,发生Cl2+H2O═H++Cl-+HC1O,则该反应的平衡常数表达式K=$\frac{c({H}^{+})c(C{l}^{-})c(HClO)}{c(C{l}_{2})}$.下列关于氯水的叙述正确的是AD(填写序号).
A.向氯水中加入少量Na2CO3粉末,其漂白性增强
B.向氯水中通人氯气,c(H+)/c(ClO-)减小
C.加水稀释氯水,溶液中的所有离子浓度均减小
D.加水稀释氯水,水的电离平衡向正反应方向移动
(3)漂白液的有效成分是NaClO,研究漂白液的稳定性对
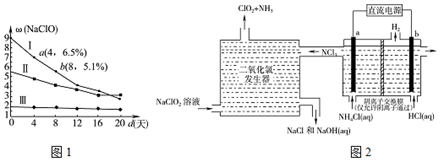
其生产和保存有实际意义.图1是30℃时,三种漂白液中NaClO的质量分数随时间的变化关系.
①分解速率v(I)>v(Ⅱ)(填“>”“<”或“=”)
②漂白液I在4~8天内的分解速率为3.5g'L-l.d-1.(常温下漂白液的密度近似等于1g•cm-3,溶液体积变化忽略不计)
(4)ClO2是一种安全稳定的消毒剂.工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2,原理如图2:
①a电极上产生的NCl3分子,常温下是一种黄色粘稠的油状液体,该分子的电子式为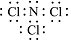 .
.
②电解池中总反应的离子方程式为NH4++2H++3Cl-$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑.
③若电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则理论上b电极上产生氢气的质量为
0.6g.
(1)氯气是合成含氯消毒剂的原料.在催化剂、420℃的条件下,氧气与氯化氢气体反应可置换出氯气,利用表数据写出该反应的热化学方程式O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-133KJ/mol.
| 化学键 | Cl-Cl | O=O | O-H | H-Cl |
| 键能(kJ.mol-1) | 247 | 498 | 463 | 431 |

A.向氯水中加入少量Na2CO3粉末,其漂白性增强
B.向氯水中通人氯气,c(H+)/c(ClO-)减小
C.加水稀释氯水,溶液中的所有离子浓度均减小
D.加水稀释氯水,水的电离平衡向正反应方向移动
(3)漂白液的有效成分是NaClO,研究漂白液的稳定性对
其生产和保存有实际意义.图1是30℃时,三种漂白液中NaClO的质量分数随时间的变化关系.
①分解速率v(I)>v(Ⅱ)(填“>”“<”或“=”)
②漂白液I在4~8天内的分解速率为3.5g'L-l.d-1.(常温下漂白液的密度近似等于1g•cm-3,溶液体积变化忽略不计)
(4)ClO2是一种安全稳定的消毒剂.工业上通过惰性电极电解氯化铵和盐酸的方法制备ClO2,原理如图2:
①a电极上产生的NCl3分子,常温下是一种黄色粘稠的油状液体,该分子的电子式为
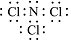 .
.②电解池中总反应的离子方程式为NH4++2H++3Cl-$\frac{\underline{\;通电\;}}{\;}$NCl3+3H2↑.
③若电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则理论上b电极上产生氢气的质量为
0.6g.
14.化学实验安全处理不正确的是( )
| A. | 苯酚沾在皮肤上用大量水冲洗 | |
| B. | 金属钠着火时,立即用沙子盖灭 | |
| C. | 制备氯气时,应用NaOH溶液吸收多余的氯气 | |
| D. | 制备乙烯时向乙醇和浓硫酸的混合液中加碎瓷片 |
11.下列选项描述的过程中,能实现化学能转化为电能的是( )
| A. |  光合作用 | B. |  烧炭取暖 | C. |  风力发电 | D. |  电解冶炼 |
18.下列过程中△H<0的是( )
| A. | 铝热反应 | B. | 煅烧石灰石 | ||
| C. | 硝酸铵的溶解 | D. | 高温下木炭还原二氧化碳 |
8.一定条件想,将X和Y气体通入1L密闭容器中,发生反应:aX(g)+bY(g)?mZ(g),5s内反应速率如下:v(X)=0.3mol•L-1•s-1,v(Y)=0.6mol•L-1•s-1,v(Z)=0.6mol•L-1•s-1,则a、b、m的值分别为( )
| A. | 1、3、2 | B. | 1、2、2 | C. | 1、3、3 | D. | 1、1、3 |
15.下列变化过程需要吸收能量的是( )
| A. | 甲烷的燃烧 | B. | H2→H+H | C. | 酸碱中和反应 | D. | CaO+H2O=Ca(OH)2 |
12.在某元素的原子核外电子排布中,K电子层和L电子层的电子数之和等于M电子层和N电子层的电子数之和.则该元素的核电荷数为( )
| A. | 12 | B. | 17 | C. | 20 | D. | 30 |
8.表是元素周期表的一部分,下列有关说法不正确的是( )
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | a | b | |||||
| 3 | c | d | e | f |
| A. | 元素 a 是制备一种高效电池的重要材料 | |
| B. | 由于分子间氢键的作用,同族中由 b 元素形成的氢化物沸点是最高的 | |
| C. | c、d 两元素的单质构成原电池两电极时,d 可能为负极 | |
| D. | e、f 的含氧酸的酸性依次增强 |