题目内容
5.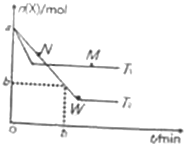 在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )| A. | 正反应方向为放热反应 | |
| B. | 在T2温度下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol•(L•min)-1 | |
| C. | M点的正反应速率v(正)大于N点的逆反应速率v(逆) | |
| D. | W点时再加入一定量X,平衡后X的转化率增大 |
分析 由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应;
A、根据以上分析,正反应为放热反应;
B、根据图中X的物质的量变化计算y的物质的量变化,再根据v(Y)=$\frac{△c}{△t}$求反应速率;
C、温度越高反应速率越大;
D、W点时再加入一定量X,达到的新平衡与原平衡比较,根据压强对平衡的影响分析.
解答 解:由图可知,温度为T1先到达平衡,所以T1>T2,温度越高,平衡时X的物质的量越大,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故逆反应为吸热反应,正反应为放热反应;
A、根据以上分析,正反应为放热反应,故A正确;
B、T2下,在0~t1时间内,X的浓度变化为:c(X)=$\frac{a-b}{2}$mol/L,则Y的浓度变化为c(Y)=$\frac{1}{2}$c(X)=$\frac{a-b}{4}$mol/L,所以v(Y)=$\frac{△c}{△t}$=$\frac{a-b}{4t{\;}_{1}}$mol•L-1•min-1,故B错误;
C、根据以上分析温度是T1>T2,则M点温度高于N点温度,温度越高反应速率越大,且N点反应没有达到平衡状态,此时反应向正反应方向进行,即N点的逆反应速率小于N点的正反应速率,因此M点的正反应速率大于N点的逆反应速率,故C正确;
D、W点时再加入一定量X,达到的新平衡与原平衡比较,压强增大,增大压强平衡正移,则X的转化率增大,所以W点时再加入一定量X,平衡后X的转化率增大,故D正确;
故选B.
点评 本题考查了化学平衡图象问题、平衡有关计算、外界条件对平衡移动影响等,难度中等,根据图象判断反应为放热反应是解题的关键.注意把握图象中曲线的变化特点,分析外界条件对化学平衡的影响.

①苯燃烧时发生明亮并带有浓烟的火焰
②苯在特定条件下能与氢气发生加成反应
③苯不与酸性高锰酸钾溶液或溴水发生反应
④苯分子具有平面正六边形结构,其中6个碳原子之间的键完全相同.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ① |
| A. | 溴水、NaOH溶液 | B. | FeCl3溶液、金属钠 | ||
| C. | 石蕊试液、溴水 | D. | KMnO4酸性溶液、石蕊试液 |
| A. | SiO2是还原剂 | |
| B. | 氧化剂与还原剂的物质的量比为2:1 | |
| C. | 此反应中电子转移4mol | |
| D. | CO是还原产物 |
①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④结合质子能力:OH->CH3COO->Cl-.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
 X、Y、Z 三种短周期元素在周期表中的位置如右图,X 通过共用三对电子形成 X2分子,下列说法不正确的是( )
X、Y、Z 三种短周期元素在周期表中的位置如右图,X 通过共用三对电子形成 X2分子,下列说法不正确的是( )| A. | 化合物 XZ3 中各原子均满足 8 电子的稳定结构 | |
| B. | X、Y、Z 三种元素形成的含氧酸都是强酸 | |
| C. | 常温下,Z 单质可与 Y 的氢化物发生置换反应 | |
| D. | 一定条件下,X2与Al反应得到 AlX |
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:4 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定不含有氧元素 |

 .
.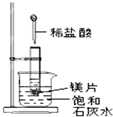 如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有 25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入 5mL 盐酸于试管中,试回答下列问题: