题目内容
13.有关SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑的反应,下列说法正确的是( )| A. | SiO2是还原剂 | |
| B. | 氧化剂与还原剂的物质的量比为2:1 | |
| C. | 此反应中电子转移4mol | |
| D. | CO是还原产物 |
分析 该反应中Si元素化合价由+4价变为0价、C元素化合价由0价变为+2价,再结合还原剂、氧化剂、氧化产物、还原产物的概念及物质间的关系来分析解答.
解答 解:A.该反应中Si元素化合价由+4价变为0价、C元素化合价由0价变为+2价,所以二氧化硅是氧化剂,故A错误;
B.该反应中Si元素化合价由+4价变为0价、C元素化合价由0价变为+2价,所以二氧化硅是氧化剂、碳是还原剂,氧化剂和还原剂的物质的量之比是1:2,其质量之比=(1×60):(2×12)=5:2,故B错误;
C.该反应中Si元素化合价由+4价变为0价、C元素化合价由0价变为+2价,该反应中生成1molSi此反应中电子转移的物质的量=1mol×(4-0)=4mol,故C正确;
D.CO是氧化产物,故D错误;
故选C.
点评 本题考查了氧化还原反应,明确元素化合价是解本题关键,根据化合价变化、物质间的关系及基本概念来分析解答,题目难度不大.

练习册系列答案
相关题目
3.向含有Cu2(OH)2CO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变大的是①c(CO${\;}_{3}^{2-}$)②c(Cu2+)③c(Cl-)④c(OH-)⑤c(H+)
| A. | ②③⑤ | B. | ①③⑤ | C. | ③④⑤ | D. | ①②④ |
1.下列仪器中,可以用酒精灯直接加热的是( )
| A. | 烧杯 | B. | 容量瓶 | C. | 试管 | D. | 蒸馏烧瓶 |
8.下列化学方程式中,能用离子方程式 H++OH-=H2O 表示的是( )
| A. | H2SO4+Ba(OH)2=BaSO4↓+2H2O | B. | HCl+NaOH=NaCl+H2O | ||
| C. | NaOH+CH3COOH=CH3COONa+H2O | D. | Cu(OH)2+2HCl=CuCl2+2H2O |
18.反应A(g)+3B(g)?2C(g)+2D(g) 在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.01mol/(L•s) | ||
| C. | v(C)=0.40mol/(L•min) | D. | v(D)=0.45mol/(L•min) |
5.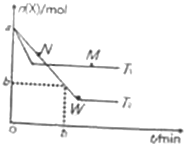 在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
 在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )| A. | 正反应方向为放热反应 | |
| B. | 在T2温度下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol•(L•min)-1 | |
| C. | M点的正反应速率v(正)大于N点的逆反应速率v(逆) | |
| D. | W点时再加入一定量X,平衡后X的转化率增大 |
2.下列各组粒子属于同位素的是( )
| A. | ${\;}_{17}^{35}$Cl和${\;}_{17}^{37}$Cl | B. | ${\;}_{19}^{40}$ K 和${\;}_{20}^{40}$ Ca | ||
| C. | O2 和 O3 | D. | H2O 和 D2O |
3.下列有关说法正确的是( )
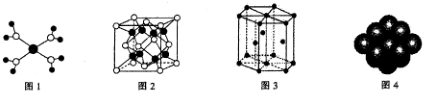

| A. | 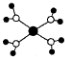 水合铜离子的模型如图所示,1个水合铜离子中含有4个配位键 | |
| B. | 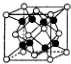 K2O晶体的晶胞如图所示,每个K2O晶胞平均占有8个O2- | |
| C. | 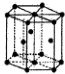 金属Zn中Zn原子堆积模型如图所示,空间利用率为68% | |
| D. |  金属Cu中Cu原子堆积模型如图,为面心立方最密堆积,每个Cu原子的配位数均为8 |