题目内容
20.下列排列顺序正确的是( )①热稳定性:H2O>HF>H2S
②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4
④结合质子能力:OH->CH3COO->Cl-.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
分析 ①非金属性越强,对应氢化物越稳定;
②电子层越多,原子半径越大,同周期从左向右原子半径减小;
③非金属性越强,对应最高含氧酸的酸性越强;
④阴离子对应的酸越弱,结合质子能力越强.
解答 解:①因元素的非金属性越强其对应的氢化物越稳定,非金属性:F>O>S,所以HF>H2O>H2S,故①错误;
②因同周期元素的半径从左至右逐渐减小,Na>Mg,O在Na和Mg的上一周期,半径最小,故②正确;
③因元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强,非金属性:Cl>S>P,酸性:HClO4>H2SO4>H3PO4,故③错误;
④因H2O、CH3COOH、HCl的电离程度:HCl>CH3COOH>H2O,所以结合质子能力OH->CH3COO->Cl-,故④正确;
故选B.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的性质、元素周期律为解答本题的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
11.下列物质的类别与所含官能团都正确的是( )
| A. | 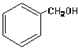 酚类-OH 酚类-OH | B. | 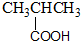 羧酸-CHO 羧酸-CHO | ||
| C. | 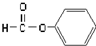 醛类-CHO 醛类-CHO | D. | CH3-O-CH3 醚类 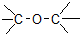 |
8.下列化学方程式中,能用离子方程式 H++OH-=H2O 表示的是( )
| A. | H2SO4+Ba(OH)2=BaSO4↓+2H2O | B. | HCl+NaOH=NaCl+H2O | ||
| C. | NaOH+CH3COOH=CH3COONa+H2O | D. | Cu(OH)2+2HCl=CuCl2+2H2O |
5.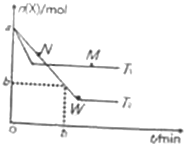 在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
 在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )| A. | 正反应方向为放热反应 | |
| B. | 在T2温度下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol•(L•min)-1 | |
| C. | M点的正反应速率v(正)大于N点的逆反应速率v(逆) | |
| D. | W点时再加入一定量X,平衡后X的转化率增大 |
12.下列有关物质分类或归类正确的是( )
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、石炭酸
④同素异形体:C60、C70、金刚石、石墨烯
⑤同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑥同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯.
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、石炭酸
④同素异形体:C60、C70、金刚石、石墨烯
⑤同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑥同分异构体:乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯.
| A. | ①③④ | B. | ②③④ | C. | ③④ | D. | ②④⑥ |
9.化学反应 A2+B2═2AB 的能量变化如图所示,则下列说法中正确的是( )
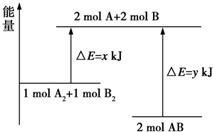

| A. | 该反应过程吸收能量 | |
| B. | 断裂 1molA-A 键和 1molB-B 键可放出 x kJ 能量 | |
| C. | 形成 2molA-B 键需要放出 y kJ 能量 | |
| D. | 2molAB 的总能量高于 1molA2和 1molB2的总能量 |
10.如表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同),原子结构示意图为 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的化学式是:NaOH.
(3)③、④、⑥三种元素形成的离子,离子半径由大到小的顺序是S2->O2->Na+.
(4)最高价氧化物是两性氧化物,该两性氧化物与氢氧化钠反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(5)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为Cl2+H2O=H++Cl-+HClO.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的化学式是:NaOH.
(3)③、④、⑥三种元素形成的离子,离子半径由大到小的顺序是S2->O2->Na+.
(4)最高价氧化物是两性氧化物,该两性氧化物与氢氧化钠反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(5)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为Cl2+H2O=H++Cl-+HClO.

 .
.
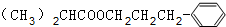 +H2O.
+H2O. .
.