题目内容
15.某化合物3.2g在氧气中完全燃烧,只生成4.4g CO2和3.6g H2O.下列说法正确的是( )| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳、氢原子个数比为1:4 | ||
| C. | 无法确定该化合物是否含有氧元素 | D. | 该化合物中一定不含有氧元素 |
分析 完全燃烧,只生成4.4g CO2和3.6g H2O,则有机物一定含C、H元素,m(C)=$\frac{4.4g}{44g/mol}$×12g/mol=1.2g,m(H)=$\frac{3.6g}{18g/mol}$×2×1g/mol=0.4g,1.2g+0.4g=1.6g<3.2g,则有机物一定含O元素,以此来解答.
解答 解:完全燃烧,只生成4.4g CO2和3.6g H2O,则有机物一定含C、H元素,m(C)=$\frac{4.4g}{44g/mol}$×12g/mol=1.2g,m(H)=$\frac{3.6g}{18g/mol}$×2×1g/mol=0.4g,1.2g+0.4g=1.6g<3.2g,则有机物一定含O元素,
A.有机物含C、H、O元素,故A错误;
B.该化合物中碳、氢原子个数比为$\frac{4.4g}{44g/mol}$:$\frac{3.6g}{18g/mol}$×2=1:4,故B正确;
C.由上述计算可知一定含O元素,故C错误;
D.该化合物一定含O元素,故D错误;
故选B.
点评 本题考查有机物分子式计算的确定,为高频考点,把握有机物的燃烧规律及原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
5.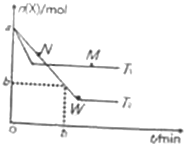 在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
 在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )
在2L密闭容器中通入amolX气体并发生反应:2X(g)?Y(g),在T1、T2温度下,X的物质的量n(X)随时间t变化的曲线如图所示.下列叙述不正确的是( )| A. | 正反应方向为放热反应 | |
| B. | 在T2温度下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol•(L•min)-1 | |
| C. | M点的正反应速率v(正)大于N点的逆反应速率v(逆) | |
| D. | W点时再加入一定量X,平衡后X的转化率增大 |
6.下列物质中,属于酚类的是( )
| A. | C6H5CH2OH | B. |  | C. |  | D. | CH3Cl |
3.下列有关说法正确的是( )

| A. | 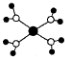 水合铜离子的模型如图所示,1个水合铜离子中含有4个配位键 | |
| B. |  K2O晶体的晶胞如图所示,每个K2O晶胞平均占有8个O2- | |
| C. | 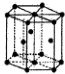 金属Zn中Zn原子堆积模型如图所示,空间利用率为68% | |
| D. |  金属Cu中Cu原子堆积模型如图,为面心立方最密堆积,每个Cu原子的配位数均为8 |
10.如表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同),原子结构示意图为 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的化学式是:NaOH.
(3)③、④、⑥三种元素形成的离子,离子半径由大到小的顺序是S2->O2->Na+.
(4)最高价氧化物是两性氧化物,该两性氧化物与氢氧化钠反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(5)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为Cl2+H2O=H++Cl-+HClO.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 ;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.
;元素⑩名称为溴在周期表中的位置第四周期ⅤⅡA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的化学式是:NaOH.
(3)③、④、⑥三种元素形成的离子,离子半径由大到小的顺序是S2->O2->Na+.
(4)最高价氧化物是两性氧化物,该两性氧化物与氢氧化钠反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(5)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为Cl2+H2O=H++Cl-+HClO.
9.取a g某物质在氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g.下列物质中不能满足上述结果的是( )
| A. | H2 | B. | CO | C. | CH3OH | D. | C2H5OH |
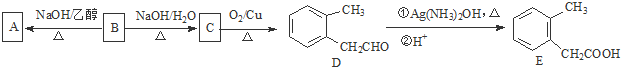
 .
.
 (或
(或 、
、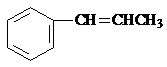 ) .
) .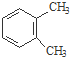 $→_{一定条件}^{Cl_{2}}$
$→_{一定条件}^{Cl_{2}}$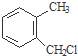 $→_{③}^{NaCN}$
$→_{③}^{NaCN}$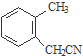 $→_{H_{2}O}^{H_{2}SO_{4}}$
$→_{H_{2}O}^{H_{2}SO_{4}}$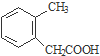
 .
. ③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中:
③CH3CH2Cl ④CH3COOH ⑤聚乙烯五种物质中: