题目内容
5.反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g)在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(x)(反应物的消耗速率或产物的生成速率)可表示为( )| A. | v(NH3)=0.010mol/(L•s) | B. | v(O2)=0.0010mol/(L•s) | ||
| C. | v(NO)=0.0010mol/(L•s) | D. | v(H2O)=0.045mol/(L•s) |
分析 在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol/(L•s),结合反应速率之比等于化学计量数之比计算.
解答 解:在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol/(L•s),
由反应速率之比等于化学计量数之比可知,v(NH3)=v(NO)=0.0015mol/(L•s)×$\frac{4}{6}$=0.0010mol/(L•s);
v(O2)=0.0015mol/(L•s)×$\frac{5}{6}$=0.00125mol/(L•s),
故选C.
点评 本题考查化学反应速率的计算,为高频考点,把握速率的计算公式、反应速率与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
14.含有一个叁键的炔烃,氢化后结构式为 ,此炔烃可能有的结构简式有( )
,此炔烃可能有的结构简式有( )
 ,此炔烃可能有的结构简式有( )
,此炔烃可能有的结构简式有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
15.1mol烷烃,完全燃烧时需要5mol O2,则该烃的C、H原子个数和为( )
| A. | 8 | B. | 9 | C. | 11 | D. | 14 |
10.某元素的一种同位素原子${\;}_{Z}^{A}$X,它与3H原子组成HmX分子,在agHmX中所含中子的物质的量是( )
| A. | $\frac{a}{A}$(A-Z+2m)mol | B. | $\frac{a}{A}$(A+2m)mol | C. | $\frac{a}{A+m}$(A-Z+3m)mol | D. | $\frac{a}{A+3m}$ (A-Z+2m)mol |
17.下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号.其中J为0族元素.
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1)R原子的电子排布图为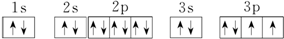 .
.
(2)在化合物YZ2中Y的化合价为+2;Y2-与Na+的半径大小为O2->Na+.
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是F>O>N;X与Y的第一电离能:X>Y(填“<”、“>”或“=”),其理由是N原子的p轨道为半充满,能量低较稳定,难失电子.
| X | Y | Z | |
| R | |||
| W | |||
| J |
(1)R原子的电子排布图为
 .
.(2)在化合物YZ2中Y的化合价为+2;Y2-与Na+的半径大小为O2->Na+.
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是F>O>N;X与Y的第一电离能:X>Y(填“<”、“>”或“=”),其理由是N原子的p轨道为半充满,能量低较稳定,难失电子.
15.一种炔烃完全燃烧后,生成CO2和H2O的物质的量之比为5:4,则这种炔烃可能的结构有( )
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
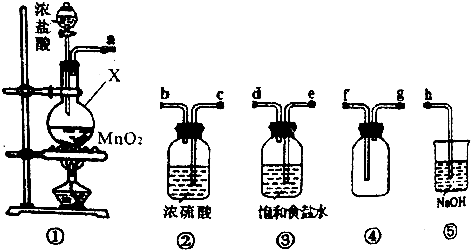
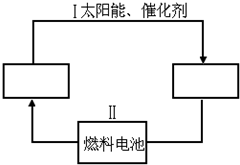 能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题.
能源可化分为一级能源和二级能源.自然界以现成方式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源.氢气是一种高效而没有污染的二级能源,而如何快速制取出大量的氢气则成为发展氢能源的主要问题. .
.