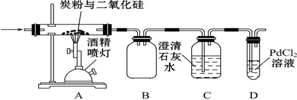
题目内容
20.原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物.(1)请写出下列元素的元素符号:ZS,WCl;请写出Y2O2的电子式:
 .
.(2)X、Z、W三种元素的最高价氧化物对应的水化物中,酸性最强的是(填化学式):HClO4.
(3)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应,请写出实验室制备该气体的化学反应方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;检验该气体是否收集满的操作方法将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口,如果试纸变蓝,则说明已经收集满.
(4)Q是和Y同一主族的原子序数最大的元素,下列关于Q的说法正确的有ACD
A.熔点较低
B.不与水反应
C.其最高价氧化物对应水化物为碱性
D.可以电解其熔融态的氯化物制取
E.碳酸盐受热易分解为氧化物和二氧化碳.
分析 原子序数由小到大排列的四种短周期元素X、Y、Z、W,Y与氧元素可组成Y2O和Y2O2离子化合物,则Y为钠元素,X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物,X原子序数都小于钠,所以X为氮元素,Z、W原子序数都大于钠,Z为硫元素,W为氯元素,据此答题.
解答 解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,Y与氧元素可组成Y2O和Y2O2离子化合物,则Y为钠元素,X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物,X原子序数都小于钠,所以X为氮元素,Z、W原子序数都大于钠,Z为硫元素,W为氯元素,
(1)Z为S,W为Cl,Y2O2为过氧化钠,电子式为 ,故答案为:S;Cl;
,故答案为:S;Cl; ;
;
(2)非金属性越强,元素的最高价氧化物对应的水化物的酸性越强,在氮、硫、氯中氯元素的非金属性最强,所以酸性最强的是HClO4,
故答案为:HClO4;
(3)NH3与H2S和HCl都能反应,生成对应的铵盐,而实验室制备NH3的化学方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O,而由于氨气是唯一的碱性气体,故检验氨气是否集满的方法是将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口,如果试纸变蓝,则说明已经收集满,故答案为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ CaCl2+2NH3↑+2H2O;将湿润的红色石蕊试纸粘在玻璃棒上,靠近集气瓶口,如果试纸变蓝,则说明已经收集满;
(4)Q是和Y同一主族的原子序数最大的元素,故Q为钫.
A.碱金属元素的单质,从上到下,熔点逐渐降低,故Q的熔点很低,故A正确;
B.碱金属元素的单质,从上到下还原性逐渐增强,故与水反应越来越容易,故B错误;
C.碱金属元素的单质,从上到下还原性逐渐增强,其最高价氧化物对应水化物的碱性逐渐增强,故Q的最高价氧化物的水化物呈强碱性,故C正确;
D.由于Q是活泼金属,故Q离子在水溶液中不放电,但可以电解其熔融态的氯化物制取,故D正确;
E.Q的碳酸盐是可溶性碳酸盐,不易受热分解为氧化物和二氧化碳,故E错误.
故选ACD.
点评 本题主要考查了电子式、元素周期律、元素化合物知识,中等难度,解题的关键是元素推断,答题时注意基础知识的灵活运用.

 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 20种 | B. | 21 种 | C. | 22 种 | D. | 23 种 |
| t/min | 1 | 4 | 8 | 11 |
| N(H2)/mol | 6 | 2.6 | 2 | 2 |
| A. | 反应前4min的平均速率v(C02)=0.45 mol/(L min) | |
| B. | 该温度下,该反应的平衡常数为0.5 | |
| C. | 其他条件不变,升高温度,反应达到新平衡时CH30H的体积分数增大 | |
| D. | 达到平衡时,H2的转化率为25% |
| A. | 丙烯的球棍模型: | B. | 乙醇的比例模型: | ||
| C. | 乙烯的结构简式:CH2 | D. | 羟基的电子式: |
| A. | 臭氧使有色布条褪色 | B. | SO2使品红溶液褪色 | ||
| C. | 氯气使鲜花褪色 | D. | 过氧化钠使品红溶液褪色 |
 DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产使用.其结构如图,下列有关说法正确的是( )
DDT又叫滴滴涕,化学名为双对氯苯基三氯乙烷,化学式(ClC6H4)2CH(CCl3).名称从英文缩写DDT而来,为白色晶体,不溶于水,溶于煤油,可制成乳剂,是有效的杀虫剂.DDT进入食物链,是导致一些食肉和食鱼的鸟接近灭绝的主要原因.因此从70年代后滴滴涕逐渐被世界各国明令禁止生产使用.其结构如图,下列有关说法正确的是( )| A. | DDT属于烃类 | |
| B. | DDT完全燃烧后只产生CO2和H2O两种物质 | |
| C. | DDT分子中无手性碳原子 | |
| D. | 氢核磁共振谱图中有3种位置峰 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
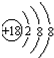 ;
;(2)表中能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与⑨的最高价氧化物对应的水化物反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)元素④与元素⑦形成的化合物中的化学键类型是离子键,写出该化合物的电子式:
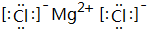 ;
;(4)①②⑥⑦四种元素的最高价氧化物对应的水化物中酸性最弱的是H2CO3(填化学式);
(5)元素③与元素⑩两者核电荷数之差是26;
(6)气态氢化物能与其最高价氧化物对应的水化物反应生成盐的元素是:②(填序号);
(7)④⑤⑥⑦四种元素的简单离子的半径由大到小的顺序为:S2->Cl->Mg2+>Al3+(填化学式).