题目内容
3.某液中可能存在Br-、CO32-、SO32-、Al3+、Cl-、K+等等六种离子中的某几种.现取该溶液进行实验,得到如下现象:实验1:向溶液中滴加足量氯水后,溶液变橙色,且有无色气体逸出;
实验2:向所得橙色溶液加CCl4萃取后,取水层滴加AgNO3溶液,出现白色沉淀;
实验3:向实验1所得溶液中加入足量BaCl2溶液,无沉淀生成.
根据上面的操作和现象推断,下列说法正确的是( )
| A. | 产生的无色气体中一定有CO2,可能有SO2 | |
| B. | 溶液中一定存在Br-、CO32,不存在Al3+、SO32- | |
| C. | 溶液中一定存在K+,可能存在Al3+、Cl- | |
| D. | 溶液变橙色时发生反应的离子方程式为Br-+Cl2=Br2+Cl- |
分析 实验1:向溶液中滴加足量氯水后,溶液变橙色,说明溶液中含有Br-,且有无色气泡冒出,说明溶液中含离子SO32-、CO32-,至少含其中一种;
实验2:向所得橙色溶液加CCl4萃取后,取水层滴加AgNO3溶液,出现白色沉淀生成,该沉淀为硫酸钡或亚硫酸钡或氯化银,则原溶液中一定存在SO32-、CO32-,至少含其中一种,由于引进了氯离子,则无法判断原溶液中是否含有Cl-;
实验3:向实验1所得溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32-.
该溶液中一定存在的离子为K+、Br-、CO32-,一定不存在的离子为Al3+、SO32-,可能存在Cl-.
解答 解:A.实验1:向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出,说明反应生成的溴单质,气体为二氧化碳、或二氧化硫,但实验3:向实验1所得溶液中加入足量BaCl2溶液,无沉淀生成,说明不含SO32-,则溶液中一定存在Br-、CO32-,无色气体中一定为CO2,不可能有SO2,故A错误;
B.溶液中含有CO32-,则一定不含有Al3+,因Al3+与CO32-发生双水解反应不能共存,生成沉淀,实验3说明不含SO32-,故B正确;
C.根据溶液呈电中性原则,溶液中一定含有K+,溶液中含有CO32-,则一定不含有Al3+,实验1引进了氯离子,则无法判断原溶液中是否含有Cl-,故C错误;
D.溶液变橙色时发生反应的离子方程式为2Br-+Cl2=Br2+2Cl-,故D错误;
故选B.
点评 本题考查离子的检验及离子共存问题,题目难度中等,注意把握反应的实验现象,结合离子的性质进行判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,22.4 L氩气约含2 NA个氩原子 | |
| B. | 14 g乙烯和丙烯混合气体中含有2 NA个氢原子 | |
| C. | 标准状况下,2.24 L CCl4含有0.4 NA根共价键 | |
| D. | 1 mol N2与3 mol H2充分反应,生成2 NA个NH3分子 |
15.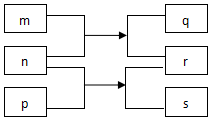 短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
 短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )
短周期主族元素X、Y、Z、W、R原子序数依次增大.m、p、r是这些元素组成的二元化合物,n、q、s是这些元素组成的三元化合物且属于离子化合物,其中s的水溶液俗称水玻璃,0.1mol/L n溶液的pH为13,m可制作耐火管且属于两性物质.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 离子半径大小:Y>Z>W | |
| B. | 简单气态氢化物的稳定性:R>Y | |
| C. | W的最高价氧化物对应的水化物碱性比Z的强 | |
| D. | 单质熔点:Z>R>X |
12.下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是( )
| A. | MgO固体(Al2O3) | B. | Na2CO3溶液(NaHCO3) | ||
| C. | MgCl2溶液(AlCl3) | D. | 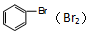 |
19.在相同温度时100mL 0.01mol/L的醋酸溶液与10mL 0.1mol/L的醋酸溶液相比较,下列数值前者大于后者的是( )
| A. | 完全中和所需NaOH的量 | B. | CH3COOH的电离程度 | ||
| C. | 溶液中H+的物质的浓度 | D. | CH3COOH的物质的量 |
15.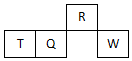 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素.下列判断错误的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素.下列判断错误的是( )| A. | 原子半径:T>Q | |
| B. | 元素非金属性:Q>R | |
| C. | 气态氢化物的热稳定性:R>Q | |
| D. | 最高价氧化物对应水化物的酸性:W>Q |
12.下列气体不会造成大气污染的是( )
| A. | N2 | B. | SO2 | C. | CO | D. | NO2 |
13.单质Z是一种常见的半导体材料,可由X通过如图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
X$→_{加热}^{Mg}$Mg2Z$\stackrel{盐酸}{→}$Y$\stackrel{加热}{→}$Z
下列说法正确的是( )
X$→_{加热}^{Mg}$Mg2Z$\stackrel{盐酸}{→}$Y$\stackrel{加热}{→}$Z
下列说法正确的是( )
| A. | X为酸性氧化物,能与碱反应,不能与酸反应 | |
| B. | Y的化学式为SiH4 | |
| C. | X、Z都含有非极性共价键 | |
| D. | X与Mg在加热条件下反应的化学方程式为SiO2+2Mg$\frac{\underline{\;△\;}}{\;}$2MgO+Si |
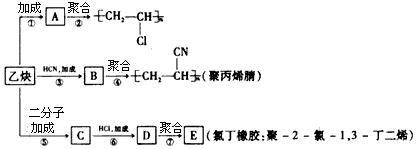
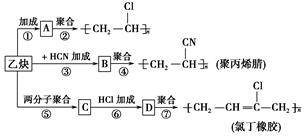
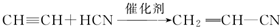 ;加成反应
;加成反应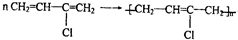 ;加聚反应
;加聚反应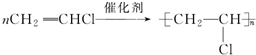 ,写出聚氯乙烯的链节
,写出聚氯乙烯的链节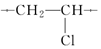 ,单体的结构简式CHCl═CH2;
,单体的结构简式CHCl═CH2; .
.