题目内容
12.下列物质中所含的杂质(括号中是杂质),使用NaOH溶液不能除去的是( )| A. | MgO固体(Al2O3) | B. | Na2CO3溶液(NaHCO3) | ||
| C. | MgCl2溶液(AlCl3) | D. | 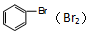 |
分析 A.氧化铝与NaOH反应,而MgO不能;
B.碳酸氢钠与NaOH反应生成碳酸钠;
C.二者均与NaOH反应;
D.溴与NaOH反应后,与溴苯分层.
解答 解:A.氧化铝与NaOH反应,而MgO不能,则使用NaOH溶液、过滤可除杂,故A正确;
B.碳酸氢钠与NaOH反应生成碳酸钠,则使用NaOH溶液可除杂,故B正确;
C.二者均与NaOH反应,则使用NaOH溶液不能除杂,故C错误;
D.溴与NaOH反应后,与溴苯分层,则使用NaOH溶液、分液可分离,故D正确;
故选C.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、混合物分离方法为解答本题的关键,侧重分析与应用的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
2.120mL含有0.20mol碳酸钠的溶液和200mL1.5mol/L盐酸,①将前者滴加入后者,②将后者滴加入前者.不合理的描述是( )
| A. | 都有气体产生 | B. | 最终产生的气体体积相同 | ||
| C. | ①中一开始就产生气体 | D. | ②中一开始不产生气体 |
3.某溶液中含有大量的 K+、Cl-及 X与 Y两种离子,现向该溶液加入 W试剂,根据实验现象得到的关于X、Y
离子的推断能成立的是( )
离子的推断能成立的是( )
| W试剂 | 实验现象 | X、Y离子的推测 | |
| A | KI-淀粉溶液 | 溶液变蓝 | Fe3+、SO42- |
| B | 用pH试纸检测 | pH=7(常温) | CH3COO-、Na+ |
| C | 硝酸酸化的AgNO3溶液 | 白色沉淀 | CO32-、NH4+ |
| D | 过量NaOH溶液 | 无明显现象 | Al3+、Mg2+ |
| A. | A | B. | B | C. | C | D. | D |
20.设NA为阿伏加德罗常数的值.下列有关叙述正确的是( )
| A. | 标准状况下,22.4 L CH4含有的共价键数为NA | |
| B. | 1 mol Fe与1mol Cl2充分反应,电子转移数为3NA | |
| C. | 常温下,pH=2的醋酸溶液中含有的H+数目为0.02NA | |
| D. | 常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA |
7.《本草经集注》中记载了区别硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”,这是运用了硝石的( )
| A. | 焰色反应 | B. | 氧化性 | C. | 还原性 | D. | 不稳定性 |
17.同温同压下两个容积相等的贮气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶气体一定具有相同的( )
| A. | 质量 | B. | 密度 | C. | 碳原子数 | D. | 原子总数 |
3.某液中可能存在Br-、CO32-、SO32-、Al3+、Cl-、K+等等六种离子中的某几种.现取该溶液进行实验,得到如下现象:
实验1:向溶液中滴加足量氯水后,溶液变橙色,且有无色气体逸出;
实验2:向所得橙色溶液加CCl4萃取后,取水层滴加AgNO3溶液,出现白色沉淀;
实验3:向实验1所得溶液中加入足量BaCl2溶液,无沉淀生成.
根据上面的操作和现象推断,下列说法正确的是( )
实验1:向溶液中滴加足量氯水后,溶液变橙色,且有无色气体逸出;
实验2:向所得橙色溶液加CCl4萃取后,取水层滴加AgNO3溶液,出现白色沉淀;
实验3:向实验1所得溶液中加入足量BaCl2溶液,无沉淀生成.
根据上面的操作和现象推断,下列说法正确的是( )
| A. | 产生的无色气体中一定有CO2,可能有SO2 | |
| B. | 溶液中一定存在Br-、CO32,不存在Al3+、SO32- | |
| C. | 溶液中一定存在K+,可能存在Al3+、Cl- | |
| D. | 溶液变橙色时发生反应的离子方程式为Br-+Cl2=Br2+Cl- |
20.食用酱油中的“氯丙醇”是多种氯代丙醇的总称.其中,二氯丙醇(不含主 结构)共有( )
结构)共有( )
 结构)共有( )
结构)共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
1.已知25℃时有关弱酸的电离平衡常数:
根据上述已知数据,回答下列问题:
(1)三种酸(CH3COOH、HCN、H2CO3)的酸性由强到弱的顺序是CH3COOH>H2CO3>HCN
(2)等物质的量的三种算的正盐(CH3COONa、NaCN、Na2CO3),其pH由大到小的顺序是Na2CO3溶液>NaCN溶液>CH3COONa溶液.
(3)常温下,体积为10ml pH=2的CH3COOH溶液与HCN溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者>后者(填“>”、“<”或“=”).
(4)用电离方程式表示NaCN溶液显碱性的原因CN-+H2O?HCN+OH-,其溶液中离子浓度由大到小的关系是c(Na+)>c(CN-)>c(OH-)>c(H+).
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
(1)三种酸(CH3COOH、HCN、H2CO3)的酸性由强到弱的顺序是CH3COOH>H2CO3>HCN
(2)等物质的量的三种算的正盐(CH3COONa、NaCN、Na2CO3),其pH由大到小的顺序是Na2CO3溶液>NaCN溶液>CH3COONa溶液.
(3)常温下,体积为10ml pH=2的CH3COOH溶液与HCN溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者>后者(填“>”、“<”或“=”).
(4)用电离方程式表示NaCN溶液显碱性的原因CN-+H2O?HCN+OH-,其溶液中离子浓度由大到小的关系是c(Na+)>c(CN-)>c(OH-)>c(H+).