题目内容
15.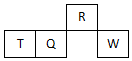 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素.下列判断错误的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素.下列判断错误的是( )| A. | 原子半径:T>Q | |
| B. | 元素非金属性:Q>R | |
| C. | 气态氢化物的热稳定性:R>Q | |
| D. | 最高价氧化物对应水化物的酸性:W>Q |
分析 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,T、Q、W位于第三周期,其中只有T为金属元素,则T为Al元素,根据相对位置可知Q为Si元素、W为S元素、R为N元素,据此结合元素周期律知识解答.
解答 解:短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,T、Q、W位于第三周期,其中只有T为金属元素,则T为Al元素,根据相对位置可知Q为Si元素、W为S元素、R为N元素,
A.同一周期中,原子序数越大,原子半径越小,则原子半径T>Q,故A正确;
B.Q为Si、R为N元素,最高价含氧酸硝酸的酸性大于硅酸,则N的非金属性较强,即元素非金属性:Q<R,故B错误;
C.非金属性越强,氢化物稳定性越强,则气态氢化物的热稳定性:R>Q,故C正确;
D.非金属性越强,最高价含氧酸的酸性越强,非金属性Q<W,则最高价氧化物对应水化物的酸性:W>Q,故D正确;
故选B.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确元素周期表结构为解答关键,注意掌握元素周期律内容及应用方法,试题培养了学生的灵活应用基础知识的能力.

练习册系列答案
相关题目
6.以下离子中,半径最大的是( )
| A. | Na+ | B. | K+ | C. | S2- | D. | Cl- |
7.《本草经集注》中记载了区别硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”,这是运用了硝石的( )
| A. | 焰色反应 | B. | 氧化性 | C. | 还原性 | D. | 不稳定性 |
3.某液中可能存在Br-、CO32-、SO32-、Al3+、Cl-、K+等等六种离子中的某几种.现取该溶液进行实验,得到如下现象:
实验1:向溶液中滴加足量氯水后,溶液变橙色,且有无色气体逸出;
实验2:向所得橙色溶液加CCl4萃取后,取水层滴加AgNO3溶液,出现白色沉淀;
实验3:向实验1所得溶液中加入足量BaCl2溶液,无沉淀生成.
根据上面的操作和现象推断,下列说法正确的是( )
实验1:向溶液中滴加足量氯水后,溶液变橙色,且有无色气体逸出;
实验2:向所得橙色溶液加CCl4萃取后,取水层滴加AgNO3溶液,出现白色沉淀;
实验3:向实验1所得溶液中加入足量BaCl2溶液,无沉淀生成.
根据上面的操作和现象推断,下列说法正确的是( )
| A. | 产生的无色气体中一定有CO2,可能有SO2 | |
| B. | 溶液中一定存在Br-、CO32,不存在Al3+、SO32- | |
| C. | 溶液中一定存在K+,可能存在Al3+、Cl- | |
| D. | 溶液变橙色时发生反应的离子方程式为Br-+Cl2=Br2+Cl- |
20.食用酱油中的“氯丙醇”是多种氯代丙醇的总称.其中,二氯丙醇(不含主 结构)共有( )
结构)共有( )
 结构)共有( )
结构)共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
4.下列有关物质的分离说法正确的是( )
| A. | 检查是否漏水是滴定管、容量瓶、分液漏斗等仪器使用的第一步操作 | |
| B. | 碘水中加CCl4振荡静置后,上层为紫色,下层几乎为无色 | |
| C. | 可用加热法分离NH4Cl(s)和I2(s) | |
| D. | 蒸馏、分馏和干馏都是利用组分沸点不同而分离的方法 |
5.下列解释事实的方程式正确的是( )
| A. | 在空气中切开金属钠,光亮表面变暗:2Na+O2═Na2O2 | |
| B. | 向氯化铝溶液中加入过量氨水,产生白色沉淀:Al3++3OH-═Al(OH)3 | |
| C. | 将铁粉与水蒸气共热,产生气体:2Fe+3H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$ Fe2O3+3H2↑ | |
| D. | Al2O3 粉末溶于 NaOH 溶液中:Al2O3+2OH-═2AlO2-+H2O |
