题目内容
18.下列物质中氧原子数目与11.7g Na2O2中氧原子数一定相等的是( )| A. | 6.72 L CO | B. | 6.6 g CO2 | C. | 24 g SO3 | D. | 9.8 g H2SO4 |
分析 根据n=$\frac{m}{M}$计算各物质的物质的量,进而计算含有O原子物质的量,氧原子物质的量相等,则含有氧原子数目相等,注意A选项中CO不一定是标况下,其物质的量不能确定.
解答 解:11.7g Na2O2中氧原子物质的量=$\frac{11.7g}{78g/mol}$×2=0.3mol,
A.CO不一定是标况下,其物质的量不能确定,故A错误;
B.6.6g CO2中氧原子物质的量=$\frac{6.6g}{44g/mol}$×2=0.3mol,故B正确;
C.24 g SO3中氧原子物质的量=$\frac{24g}{80g/mol}$×3=0.9mol,故C错误;
D.9.6g H2SO4中氧原子物质的量=$\frac{9.8g}{98g/mol}$×4=0.4mol,故D错误,
故选B.
点评 本题考查物质的量有关计算,难度不大,A选项为易错点,学生容易忽略CO所处的状态,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )
| A. | 向水中加入少量Na固体,平衡逆向移,c(H+)降低 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,c(H+)增大,Kw不变动 | |
| D. | 将水加热,Kw增大,pH不变 |
9.有关化学平衡常数(K)的说法中不正确的是( )
| A. | 一般地说,K>105时,该反应进行得就基本完全了 | |
| B. | 对一个确定的反应,K值越大,正反应进行的程度越大 | |
| C. | 在温度一定时,K与反应物或生成物的浓度变化无关 | |
| D. | 温度越高,K值越大 |
6.下列设计的实验方案能达到实验目的是( )


| A. | 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡 | |
| B. | 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间 | |
| C. | 中和热测定实验中把盐酸分多次加入氢氧化钠溶液中 | |
| D. | 酸碱中和滴定实验中锥形瓶需要用待测液润洗 |
13.下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A. | K+、H+、Fe2+、MnO4- | B. | Fe3+、Ba2+、SO42-、NO3- | ||
| C. | Al3+、Na+、SO42-、CO32- | D. | Fe3+、H+、SO42-、ClO- |
3.下列热化学方程式中的△H表示可燃物燃烧热的是( )
| A. | 2H2(g)+O2(g)=2H2O(l)△H1 | B. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H2 | ||
| C. | HCl(aq)+NaOH(aq)=NaCl(aq)+H2O( l )△H3 | D. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O( l )△H4 |
20.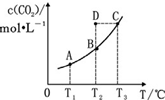 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度 c(CO2)与温度 T 的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度 c(CO2)与温度 T 的关系如图所示.下列说法错误的是( )
 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度 c(CO2)与温度 T 的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度 c(CO2)与温度 T 的关系如图所示.下列说法错误的是( )| A. | 反应 CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在 T2时,若反应处于状态 D,则有 v 正<v 逆 | |
| C. | 平衡状态 A 与 C 相比,平衡状态 A 的 c(CO)小 | |
| D. | 若 T1、T2时的平衡常数分别为 K1、K2,则 K1<K2 |