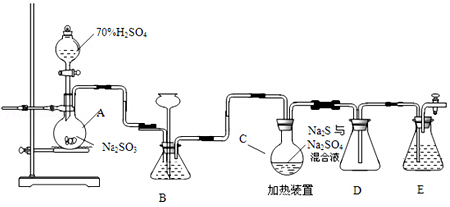
题目内容
9.有关化学平衡常数(K)的说法中不正确的是( )| A. | 一般地说,K>105时,该反应进行得就基本完全了 | |
| B. | 对一个确定的反应,K值越大,正反应进行的程度越大 | |
| C. | 在温度一定时,K与反应物或生成物的浓度变化无关 | |
| D. | 温度越高,K值越大 |
分析 K为生成物浓度幂之积与反应物浓度幂之积的比,K越大,反应正向进行的趋势越大,且K只与温度有关,以此来解答.
解答 解:A.一般地说,K>105时,反应物转化为生成物的转化率很大,该反应进行得就基本完全了,故A正确;
B.K可衡量正向进行的趋势,则对一个确定的反应,K值越大,正反应进行的程度越大,故B正确;
C.在温度一定时,K不变,则K与反应物或生成物的浓度变化无关,故C正确;
D.若为吸热反应,温度越高,K值越大,若为放热反应,温度越高K值越小,故D错误;
故选D.
点评 本题考查化学平衡常数的意义,为高频考点,把握K与温度的关系、K的意义为解答的关键,侧重分析与应用能力的考查,注意选项D中反应为吸热反应或放热反应,题目难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
20.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. | 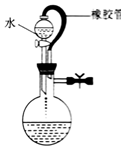 该装置气密性良好 | B. |  实验室制备氯气 | ||
| C. | 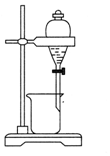 分离酒精和水 | D. | 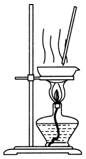 蒸干NH4Cl溶液制NH4Cl固体 |
17.下列溶液中的Cl-物质的量浓度与100mL 1mol•L-1AlCl3溶液中Cl-浓度相等的是( )
| A. | 75mL 2mol•L-1氯化镁溶液 | B. | 150mLl 1 mol•L-1氯化钠溶液 | ||
| C. | 50mL3mol•L-1氯化钾溶液 | D. | 50mL 1 mol•L-1氯化铁溶液 |
4.下列关于溶液物质的量浓度的说法正确的是( )
| A. | 标准状况下,将22.4 L HC1溶于1L水,可配成1 mol•L-l的稀盐酸 | |
| B. | 将100 mL 18 mol•L-1的浓H2SO4和100 mL水混合,可配成9 moI•L-l的H2SO4溶液 | |
| C. | 将4.0 g NaOH溶于100 mL容量瓶中,加水至刻度线,配成1 mol•L-1的NaOH溶液 | |
| D. | 将0.1 mol NaCl配成100 mL溶液,从中取出10 mL,所取出溶液的物质的量浓度为1 mol•L-l |
14.下列说法正确的是( )
| A. | SiO2是酸性氧化物,能与NaOH溶液反应生成盐和水 | |
| B. | 实验室中用石灰水区分Na2CO3与NaHCO3两瓶无标签溶液 | |
| C. | O3和O2为同种元素组成的单质,所以O3和O2互为同位素 | |
| D. | Na2O和Na2O2组成元素相同,与H2O的反应产物也相同 |
18.下列物质中氧原子数目与11.7g Na2O2中氧原子数一定相等的是( )
| A. | 6.72 L CO | B. | 6.6 g CO2 | C. | 24 g SO3 | D. | 9.8 g H2SO4 |
12.某微粒用符号${\;}_{Z}^{A}$Mn+表示,下列关于该微粒的叙述中正确的是( )
| A. | 所含质子数为(A-n) | B. | 所含中子数为Z | ||
| C. | 所含电子数为(Z+n) | D. | 中子数-电子数=A-2Z+n |