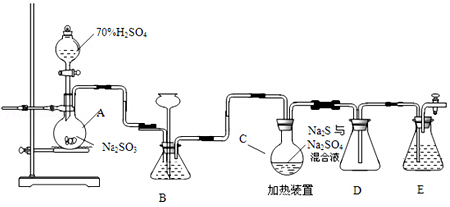
题目内容
8.25℃时,水的电离达到平衡:H2O?H++OH-,下列叙述正确的是( )| A. | 向水中加入少量Na固体,平衡逆向移,c(H+)降低 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,c(H+)增大,Kw不变动 | |
| D. | 将水加热,Kw增大,pH不变 |
分析 A.Na和水反应生成NaOH,NaOH电离出氢氧根离子导致c(OH-)升高,温度不变离子积常数不变;
B.一水合氨电离出氢氧根离子导致c(OH-)升高;
C.硫酸氢钠电离出氢离子导致c(H+)增大,温度不变离子积常数不变;
D.升高温度促进水电离导致c(H+)、c(OH-)增大.
解答 解:A.Na和水反应生成NaOH,NaOH电离出氢氧根离子导致c(OH-)升高,抑制水电离平衡逆向移动,c(H+)降低,但温度不变离子积常数不变,故A错误;
B.一水合氨电离出氢氧根离子导致c(OH-)升高,抑制水电离平衡逆向移动,故B错误;
C.硫酸氢钠电离出氢离子导致c(H+)增大,抑制水电离导致平衡逆向移动,但温度不变离子积常数不变,故C正确;
D.升高温度促进水电离导致c(H+)、c(OH-)增大,所以离子积常数增大,pH减小,故D错误;
故选C.
点评 本题以水的电离为载体考查弱电解质的电离,明确弱电解质电离及离子积常数影响因素是解本题关键,注意:离子积常数只与温度有关,与溶液浓度及溶解度无关,注意硫酸氢钠电离特点,题目难度不大.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
18.在100℃时,将0.200mol的四氧化二氮气体充入2L真空的密闭容器中,发生如下反应,N2O4═2NO2,每隔一定的时间对该容器内的物质进行分析,得到如下表格:?
请回答下列问题:?
(1)该反应达到平衡时,四氧化二氮的转化率为60%,表中c2>c3(填“>”、“<”或“=”).
(2)20s时四氧化二氮的浓度c1=0.070mol/L,在0s~20s时间段内,四氧化二氮的平均反应速率为0.0015mol/(L•s).
(3)100℃时,该反应的平衡常数K=0.36mol/L.
(4)若在相同情况下最初向该容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是0.200mol/L.
(5)若在相同情况下向该容器中充入0.2mol四氧化二氮和0.3mol二氧化氮气体,则到达平衡前v(正)> v(逆)(填“>”、“<”或“=”).
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应达到平衡时,四氧化二氮的转化率为60%,表中c2>c3(填“>”、“<”或“=”).
(2)20s时四氧化二氮的浓度c1=0.070mol/L,在0s~20s时间段内,四氧化二氮的平均反应速率为0.0015mol/(L•s).
(3)100℃时,该反应的平衡常数K=0.36mol/L.
(4)若在相同情况下最初向该容器中充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是0.200mol/L.
(5)若在相同情况下向该容器中充入0.2mol四氧化二氮和0.3mol二氧化氮气体,则到达平衡前v(正)> v(逆)(填“>”、“<”或“=”).
20.下列实验操作或装置(略去部分夹持仪器)正确的是( )
| A. | 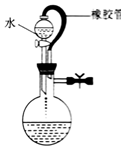 该装置气密性良好 | B. |  实验室制备氯气 | ||
| C. | 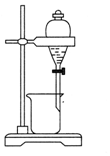 分离酒精和水 | D. | 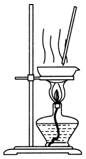 蒸干NH4Cl溶液制NH4Cl固体 |
17.下列溶液中的Cl-物质的量浓度与100mL 1mol•L-1AlCl3溶液中Cl-浓度相等的是( )
| A. | 75mL 2mol•L-1氯化镁溶液 | B. | 150mLl 1 mol•L-1氯化钠溶液 | ||
| C. | 50mL3mol•L-1氯化钾溶液 | D. | 50mL 1 mol•L-1氯化铁溶液 |
18.下列物质中氧原子数目与11.7g Na2O2中氧原子数一定相等的是( )
| A. | 6.72 L CO | B. | 6.6 g CO2 | C. | 24 g SO3 | D. | 9.8 g H2SO4 |