题目内容
海水呈弱碱性,其中含有80多种元素,溴主要以Br-形式存在.工业上利用海水制备Br2的流程如下:
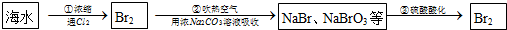
已知步骤③反应为:5NaBr+NaBrO3+3H2SO4═3Na2SO4+3Br2+3H2O.请完成下列填空:
(1)海水淡化的方法主要有 (写出一种),Br2可用热空气吹出,其原因是 .
(2)步骤③反应的离子反应方程式为 .
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中 (填序号).
①加入NaOH ②加入Na2CO3 ③加入NaBr溶液.
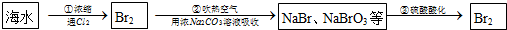
已知步骤③反应为:5NaBr+NaBrO3+3H2SO4═3Na2SO4+3Br2+3H2O.请完成下列填空:
(1)海水淡化的方法主要有
(2)步骤③反应的离子反应方程式为
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中
①加入NaOH ②加入Na2CO3 ③加入NaBr溶液.
考点:海水资源及其综合利用
专题:元素及其化合物
分析:依据流程分析,海水浓缩晒盐得到卤水中通入氧化剂氯气氧化溴离子得到溴单质,吹入热的空气用碳酸钠溶液吸收得到溴化钠,溴酸钠,富集溴,加入硫酸酸化发生氧化还原反应生成单质溴;
(1)根据海水淡化的原理分析,溴单质易挥发,常温下为液体;
(2)步骤③反应是溴化钠和溴酸钠在硫酸溶液中发生氧化还原反应生成溴单质;
(3)为了除去工业Br2中微量的Cl2,应是和氯气反应和溴单质不反应;
(1)根据海水淡化的原理分析,溴单质易挥发,常温下为液体;
(2)步骤③反应是溴化钠和溴酸钠在硫酸溶液中发生氧化还原反应生成溴单质;
(3)为了除去工业Br2中微量的Cl2,应是和氯气反应和溴单质不反应;
解答:
解:(1)海水淡化就是除去海水中溶有的各种溶质,常用的方法就是蒸馏,Br2可用热空气吹出利用的是溴单质易挥发;
故答案为:蒸馏法,溴单质易挥发,常温下为液体;
(2)步骤③反应是溴化钠和溴酸钠在硫酸溶液中发生氧化还原反应生成溴单质,反应的离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O;
故答案为:5Br-+BrO3-+6H+=3Br2+3H2O;
(3)为了除去工业Br2中微量的Cl2,应是和氯气反应和溴单质不反应;
①加入NaOH和溴单质,氯气都可以发生反应,故①不符合;
②加入Na2CO3 溶液也可以 和溴单质、氯气发生反应,故②不符合;
③加入NaBr溶液,发生反应Cl2+2NaBr=Br2+2NaCl,故③符合;
故选:③;
故答案为:蒸馏法,溴单质易挥发,常温下为液体;
(2)步骤③反应是溴化钠和溴酸钠在硫酸溶液中发生氧化还原反应生成溴单质,反应的离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O;
故答案为:5Br-+BrO3-+6H+=3Br2+3H2O;
(3)为了除去工业Br2中微量的Cl2,应是和氯气反应和溴单质不反应;
①加入NaOH和溴单质,氯气都可以发生反应,故①不符合;
②加入Na2CO3 溶液也可以 和溴单质、氯气发生反应,故②不符合;
③加入NaBr溶液,发生反应Cl2+2NaBr=Br2+2NaCl,故③符合;
故选:③;
点评:本题考查了海水提溴的生产工艺流程分析判断,物质性质是解题关键,题目较简单.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
下列说法正确的是( )
| A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动 |
| C、溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动 |
| D、电解MgCl2饱和溶液,可制得金属镁 |
下列溶液中,c(Cl-)最小的是( )
| A、20mL 0.5mol/L AlCl3溶液 |
| B、30mL 1mol/L KCl溶液 |
| C、7.5mL 2mol/L MgCl2溶液 |
| D、10mL 3mol/L NaCl溶液 |
下列物质的电子式书写正确的是( )
A、 |
B、 |
C、 |
D、 |