题目内容
17.利用金属活性的不同,可以采取不同的冶炼方法冶炼金属.下列反应所描述的冶炼方法不可能实现的是( )| A. | 2AlCl3(熔融) $\frac{\underline{\;电解\;}}{冰晶}$ 4Al+3Cl2↑ | |
| B. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | |
| C. | Fe+CuSO4═FeSO4+Cu | |
| D. | 2KCl(熔融)$\frac{\underline{\;电解\;}}{\;}$2K+Cl2↑ |
分析 金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法.
金属冶炼的方法主要有:
热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来(Hg及后边金属);
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来(Zn~Cu);
电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属,K、Ca、Na、Mg电解氯化物得到Al电解氧化铝得到.
解答 解:A、氯化铝是共价化合物不能导电,工业上是用加入冰晶石降低氧化铝的熔点,电解熔融氧化铝冶炼铝,故A错误;
B、铁位于金属活动顺序表中间位置的金属,通常用热还原法冶炼,故B正确;
C、铁比铜活泼,能从铜的盐溶液中置换出铜,故C正确;
D、电解熔融KCl,阳极上氯离子失电子发生氧化反应生成氯气,阴极上钾离子得到电子发生还原反应得到金属钾,故D正确;
故选A.
点评 本题考查了金属冶炼的一般原理,题目难度不大,注意根据金属的活泼性不同采取相应的冶炼方法.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
7.下列有关实验操作的说法正确的是( )
| A. | 用25mL碱式滴定管量取20.00mL KMnO4溶液 | |
| B. | 用pH试纸测得Ca(ClO)2溶液的pH为10 | |
| C. | 用托盘天平称取20.00 g NaOH固体 | |
| D. | 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的$\frac{2}{3}$,液体也不能蒸干 |
12.下列有关化学用语使用正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | CO2的比例模型  | ||
| C. | 氢氧根离子的电子式: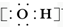 | D. | NH4Br的电子式: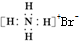 |
2.下列说法不正确的是( )
| A. | 化学反应达到化学平衡状态的正逆反应速率相等,是指同一物质的消耗速率和生成速率相等,若用不同物质表示时,反应速率不一定相等 | |
| B. | 标准状况下,1 L辛烷完全燃烧生成CO2 8 L | |
| C. | 2.4 g Mg无论与O2还是与N2完全反应,转移电子数都是0.2NA | |
| D. | 1 L 1 mol•L-1 CH3COOH溶液中,所含CH3COO-、CH3COOH的总数为NA |
9.下列关手水玻璃的性质和用途的叙述中不正确的是( )
| A. | 这是一种矿物胶,既不燃烧也不受腐蚀 | |
| B. | 在建筑工业上可以作黏合剂、耐酸水泥掺料 | |
| C. | 木材、织物浸过水玻璃后具有防腐性能且不易燃烧 | |
| D. | 水玻璃的化学性质稳定,在空气中不易变质 |
6.下列各组物质混合后,既有气体又有白色沉淀生成的是( )
| A. | 明矾和氢氧化钡溶液 | B. | 钠和MgC12溶液 | ||
| C. | 铜粉和FeC13溶液 | D. | Na2O2和少量FeCl2溶液 |
7.在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是( )


| A. | ①加CCl4 ②加苯 ③加酒精 | |
| B. | ①加酒精 ②加CCl4 ③加苯 | |
| C. | ①加苯 ②加CCl4 ③加酒精 | |
| D. | ①加苯 ②加酒精 ③加CCl4 |