题目内容
下列各电离方程式中书写正确的是( )
| A、HClO═H++ClO- |
| B、HCO3-+H2O?H2CO3+OH- |
| C、Al(OH)3?Al3++3OH- |
| D、NaH2PO4?Na++H2PO4- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.HClO为弱电解质;
B.电离生成碳酸根离子、氢氧根离子;
C.氢氧化铝为弱碱;
D.NaH2PO4为强电解质,完全电离.
B.电离生成碳酸根离子、氢氧根离子;
C.氢氧化铝为弱碱;
D.NaH2PO4为强电解质,完全电离.
解答:
解:A.HClO为弱电解质,电离方程式为HClO?H++ClO-,故A错误;
B.电离生成碳酸根离子、氢氧根离子,电离方程式为HCO3-+H2O?CO32-+OH-,故B错误;
C.氢氧化铝为弱碱,电离方程式为Al(OH)3?Al3++3OH-,故C正确;
D.NaH2PO4为强电解质,完全电离,电离方程式为NaH2PO4=Na++H2PO4-,故D错误;
故选C.
B.电离生成碳酸根离子、氢氧根离子,电离方程式为HCO3-+H2O?CO32-+OH-,故B错误;
C.氢氧化铝为弱碱,电离方程式为Al(OH)3?Al3++3OH-,故C正确;
D.NaH2PO4为强电解质,完全电离,电离方程式为NaH2PO4=Na++H2PO4-,故D错误;
故选C.
点评:本题考查离子反应书写的正误判断,为高频考点,把握电解质强弱及电离程度为解答的关键,侧重电离的离子反应考查,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
某元素由化合态变成游离态( )
| A、一定被氧化 |
| B、一定被还原 |
| C、可能被氧化,也可能被还原 |
| D、没被氧化还原 |
下列说法中正确的是( )
| A、1L水中溶解了58.5gNaCl,该溶液的物质的量浓度为1mol/L |
| B、从1L2mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1mol/L |
| C、配制480mL0.5 mol/L的CuSO4溶液,需62.5g胆矾 |
| D、10g98%的硫酸(密度为1.84 g?cm-3)与10 mL18.4 mol?L-1的硫酸的浓度不同 |
在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g?cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为( )
| A、18.4mol?L-1 34.7% |
| B、20.4mol?L-1 38.5%q2 |
| C、18.4mol?L-1 38.5% |
| D、20.4mol?L-1 34.7% |
下列各组中两种物质在溶液中的反应,可用同一离子方程式表示的是( )
| A、Cu(OH)2+HCl;CuO+HCl |
| B、K2CO3+HNO3;Na2CO3+HCl |
| C、Ba(OH)2+CuSO4;Ba(OH)2+Na2SO4 |
| D、BaCl2+H2SO4;Ba(OH)2+H2SO4 |
常温下用石墨电极电解1L 0.01mol?L-1NaCl溶液,电解一段时间后,阴极产生0.04g气体.下列说法正确的是(假设电解过程中溶液体积不变)( )
| A、电解过程中有0.02mol电子转移 |
| B、阳极产物只有氯气 |
| C、在标准状况下,阳极产生的气体体积为0.448L |
| D、电解后溶液的pH=12 |
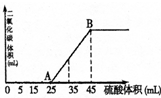 向100mL NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴加入1mol?L-1硫酸,所加入硫酸溶液体积与产生CO2体积关系如图所示:
向100mL NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴加入1mol?L-1硫酸,所加入硫酸溶液体积与产生CO2体积关系如图所示: