题目内容
在标准状况下,1体积水溶解700体积氨气,所得溶液密度为0.9g?cm-3,这种氨水的物质的量浓度和溶质的质量分数分别为( )
| A、18.4mol?L-1 34.7% |
| B、20.4mol?L-1 38.5%q2 |
| C、18.4mol?L-1 38.5% |
| D、20.4mol?L-1 34.7% |
考点:物质的量浓度的相关计算
专题:
分析:NH3溶于水后虽然大部分生成NH3?H2O,但在计算时,仍以NH3作为氨水中的溶质,设水的体积为1L,则氨气的体积为700L,由标准状况下的体积可计算氨气的物质的量,溶液质量=氨气质量+水的质量,溶液体积可由溶液的质量和密度来计算,再根据质量分数定义、物质的量浓度的定义计算.
解答:
解:NH3溶于水后虽然大部分生成NH3?H2O,但在计算时,仍以NH3作为氨水中的溶质;
设水的体积为1L,氨气的体积为700L,
则氨气的物质的量为:
=31.25mol,
氨气的质量为31.25mol×17g/mol=531.25g,
溶液的质量为1000g+31.25mol×17g/mol=1531.25g,
溶液的体积为=
=1.7L,
则氨水的质量分数为:w=
×100%=34.7%,
氨水的物质的量浓度为:c=
=18.4 mol/L,
故选A.
设水的体积为1L,氨气的体积为700L,
则氨气的物质的量为:
| 700L |
| 22.4L/mol |
氨气的质量为31.25mol×17g/mol=531.25g,
溶液的质量为1000g+31.25mol×17g/mol=1531.25g,
溶液的体积为=
| 1531.25g |
| 900g/L |
则氨水的质量分数为:w=
| 531.25g |
| 1531.25g |
氨水的物质的量浓度为:c=
| 31.25mol |
| 1.7L |
故选A.
点评:本题考查学生物质的量浓度、质量分数的计算,题目难度中等,溶液的体积计算是解答本题的关键也是学生解答本题的易错点.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
有X、Y两种元素,它们的原子序数都小于18,它们的离子属于下列哪种情况,则X、Y必属于同一周期的元素( )
| A、X、Y的离子具有相同的电子层结构 |
| B、X-比Y2-少一个电子层 |
| C、X+ 和Y2-具有相同的电子层结构 |
| D、X+比Y2-少一个电子层 |
铋(Bi)是氮族元素中原子序数最大的元素,试推测铋单质或其化合物可能具有的性质是( )
| A、铋能形成很稳定的气态氢化物 |
| B、铋的最高价氧化物对应的水化物的酸性比磷酸强 |
| C、铋单质可能具有良好的导电性并具有较大的密度 |
| D、铋的两种常见氧化物Bi2O3和Bi2O5,一定是碱性氧化物 |
下列各电离方程式中书写正确的是( )
| A、HClO═H++ClO- |
| B、HCO3-+H2O?H2CO3+OH- |
| C、Al(OH)3?Al3++3OH- |
| D、NaH2PO4?Na++H2PO4- |
铁有可变化合价,将14.4克FeC2O4(草酸亚铁)隔绝空气加热使之分解,最终可得7.6克铁的氧化物,则该铁的氧化物的组成可能是( )
| A、FeO |
| B、Fe3O4 |
| C、FeO?Fe3O4 |
| D、Fe2O3 |
在一定温度和压强下,10体积气体A2跟30体积B2化合生成20体积某气体C,则C的化学式为( )
| A、AB |
| B、A2B |
| C、AB3 |
| D、AB2 |
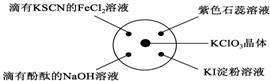 已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )  工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图如图所示.
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置示意图如图所示.