题目内容
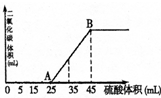 向100mL NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴加入1mol?L-1硫酸,所加入硫酸溶液体积与产生CO2体积关系如图所示:
向100mL NaOH溶液中,通入一定量CO2后,然后向该溶液中逐滴加入1mol?L-1硫酸,所加入硫酸溶液体积与产生CO2体积关系如图所示:(1)通一定量CO2后,溶液中溶质为
(2)AB段反应的离子方程式为
(3)当加入45mL硫酸溶液时,产生CO2的物质的量为
(4)计算原氢氧化钠浴液的物质的量浓度
考点:化学方程式的有关计算,离子方程式的有关计算
专题:计算题
分析:(1)25mL~45mL发生的反应为:HCO3-+H+═H2O+CO2↑,碳酸氢钠完全反应消耗硫酸20mL,小于25mL,说明加入25mL硫酸前发生的反应分别为H++OH-═H2O,CO32-+H+═HCO3-,因此通一定量CO2后,溶液中溶质为NaOH、Na2CO3;
(2)25mL~45mL发生的反应为:HCO3-+H+═H2O+CO2↑;
(3)根据n=cV计算硫酸的物质的量,再根据方程式计算生成二氧化碳的物质的量;
(4)加入45mL硫酸时,溶液中氢氧化钠、碳酸钠完全反应,此时溶液中溶质为Na2SO4,根据硫酸根守恒计算n(Na2SO4),再根据钠离子守恒计算n(NaOH),根据c=
计算原氢氧化钠浴液的物质的量浓度.
(2)25mL~45mL发生的反应为:HCO3-+H+═H2O+CO2↑;
(3)根据n=cV计算硫酸的物质的量,再根据方程式计算生成二氧化碳的物质的量;
(4)加入45mL硫酸时,溶液中氢氧化钠、碳酸钠完全反应,此时溶液中溶质为Na2SO4,根据硫酸根守恒计算n(Na2SO4),再根据钠离子守恒计算n(NaOH),根据c=
| n |
| V |
解答:
解:(1)25mL~45mL发生的反应为:HCO3-+H+═H2O+CO2↑,碳酸氢钠完全反应消耗硫酸20mL,小于25mL,说明加入25mL硫酸前发生的反应分别为H++OH-═H2O,CO32-+H+═HCO3-,因此通一定量CO2后,溶液中溶质为NaOH、Na2CO3,
故答案为:NaOH、Na2CO3;
(2)加入25mL硫酸前发生的反应分别为H++OH-═H2O,CO32-+H+═HCO3-,25mL~45mL发生的反应为:HCO3-+H+═H2O+CO2↑,
故答案为:HCO3-+H+═H2O+CO2↑;
(3)碳酸氢钠完全反应消耗硫酸为45mL-25mL=20mL,则硫酸的物质的量为0.02L×1mol/L=0.02mol,故n(H+)=0.04mol,由HCO3-+H+═H2O+CO2↑可知,生成二氧化碳为0.04mol,
故答案为:0.04mol;
(4)加入45mL硫酸时,溶液中氢氧化钠、碳酸钠完全反应,此时溶液中溶质为Na2SO4,消耗硫酸的物质的量为0.045L×1mol/L=0.045mol,根据硫酸根守恒可知n(Na2SO4)=n(H2SO4)=0.045mol,根据钠离子守恒可知n(NaOH)=2n(Na2SO4)=2×0.045mol=0.09mol,原氢氧化钠浴液的物质的量浓度为
=0.9mol/L,
故答案为:0.9mol/L.
故答案为:NaOH、Na2CO3;
(2)加入25mL硫酸前发生的反应分别为H++OH-═H2O,CO32-+H+═HCO3-,25mL~45mL发生的反应为:HCO3-+H+═H2O+CO2↑,
故答案为:HCO3-+H+═H2O+CO2↑;
(3)碳酸氢钠完全反应消耗硫酸为45mL-25mL=20mL,则硫酸的物质的量为0.02L×1mol/L=0.02mol,故n(H+)=0.04mol,由HCO3-+H+═H2O+CO2↑可知,生成二氧化碳为0.04mol,
故答案为:0.04mol;
(4)加入45mL硫酸时,溶液中氢氧化钠、碳酸钠完全反应,此时溶液中溶质为Na2SO4,消耗硫酸的物质的量为0.045L×1mol/L=0.045mol,根据硫酸根守恒可知n(Na2SO4)=n(H2SO4)=0.045mol,根据钠离子守恒可知n(NaOH)=2n(Na2SO4)=2×0.045mol=0.09mol,原氢氧化钠浴液的物质的量浓度为
| 0.09mol |
| 0.1L |
故答案为:0.9mol/L.
点评:本题考查混合物的有关计算,难度中等,清楚各阶段发生的反应是关键,利用守恒思想进行计算,侧重对学生思维能力、分析问题能力的考查.

练习册系列答案
相关题目
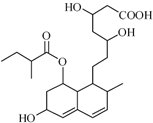 普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( )| A、能与FeCl3 溶液发生显色反应 |
| B、不能使酸性KMnO4 溶液褪色 |
| C、能发生加成、取代、消去反应 |
| D、1 mol 该物质最多可与1 mol NaOH 反应 |
制造水泥和玻璃都需用到的原料是( )
| A、粘土 | B、石英 | C、石灰石 | D、纯碱 |
新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如图:MFe2Ox
MFe2Oy,则下列判断正确的是( )
| 常温下 |
| SO2 |
| A、MFe2Ox是氧化剂 |
| B、x<y |
| C、SO2是该反应的催化剂 |
| D、SO2发生氧化反应且氧化性:MFe2Oy>SO2 |
对下列化学反应的热现象,不正确的说法是( )
| A、有些放热反应发生时需要加热 |
| B、化学反应一定既有物质变化又有能量变化 |
| C、吸热反应都需要加热后才能发生 |
| D、化学反应热效应数值与反应物质多少有关 |
下列过程放出热量的是(1)铝放入盐酸中(2)水蒸气变成掖态水(3)氧分子变成氧原子(4)煅烧石灰石生成生石灰和二氧化碳( )
| A、(1)(2) |
| B、(3)(4) |
| C、(1)(3) |
| D、(2)(4) |
下列各电离方程式中书写正确的是( )
| A、HClO═H++ClO- |
| B、HCO3-+H2O?H2CO3+OH- |
| C、Al(OH)3?Al3++3OH- |
| D、NaH2PO4?Na++H2PO4- |
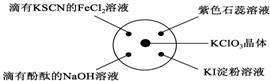 已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )