题目内容
已知酸性大小:羧酸>碳酸>酚>HCO3-.下列含溴化合物中的溴原子,在适当条件下都能被羟基(-OH)取代(均可称之为水解反应),所得产物能跟Na2CO3溶液反应的是( )
A、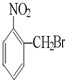 |
B、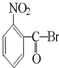 |
C、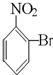 |
D、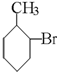 |
考点:有机物分子中的官能团及其结构,有机物的结构和性质
专题:
分析:含溴化合物中的溴原子,在适当条件下都能被羟基(-OH)取代,所得产物能跟NaHCO3溶液反应,说明水解后生成的官能团具有酸性,且酸性比H2CO3强,以此解答该题.
解答:
解:A. 水解生成
水解生成 ,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故A错误;
,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故A错误;
B. 水解生成
水解生成 ,酸性比碳酸强,可与碳酸氢钠反应,故B正确;
,酸性比碳酸强,可与碳酸氢钠反应,故B正确;
C. 水解生成
水解生成 ,酚羟基比碳酸弱,不能与碳酸氢钠反应,故C错误;
,酚羟基比碳酸弱,不能与碳酸氢钠反应,故C错误;
D. 水解生成
水解生成 ,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故D错误.
,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故D错误.
故选B.
 水解生成
水解生成 ,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故A错误;
,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故A错误;B.
 水解生成
水解生成 ,酸性比碳酸强,可与碳酸氢钠反应,故B正确;
,酸性比碳酸强,可与碳酸氢钠反应,故B正确;C.
 水解生成
水解生成 ,酚羟基比碳酸弱,不能与碳酸氢钠反应,故C错误;
,酚羟基比碳酸弱,不能与碳酸氢钠反应,故C错误;D.
 水解生成
水解生成 ,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故D错误.
,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故D错误.故选B.
点评:本题考查有机物的结构和性质,题目难度不大,注意能与碳酸氢钠反应的物质的酸性必须比碳酸强,注意有机物的结构,特别是官能团的结构和性质,把握有机物的转化.

练习册系列答案
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
常温 下,0.1mol/L氨水中
=1×10-10,下列说法正确的是( )
| c(H+) |
| c(OH-) |
| A、溶液中由水电离出的c(OH-)=1×10-10mol/L |
| B、溶液中c(OH-)+c(NH3?H2O)=0.1mol/L |
| C、与0.1mol/L 的盐酸等体积混合后所得溶液中:c(Cl-)=c(NH4+)+c(NH3?H2O)=0.1mol/L |
| D、原溶液中加入少量的氯化铵晶体或加水稀释,溶液中的c(H+)均增大 |
①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液.相同条件下,有关上述溶液的比较中,错误的是( )
| A、将②、③溶液混合后,pH=7,消耗溶液的体积:②>③ |
| B、①④等体积混合后,溶液显碱性 |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量①最大 |
| D、向溶液中加入100mL水后,溶液的pH:③>④>②>① |
下列有关化学反应速率的说法正确的是( )
| A、用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
| B、100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速度减小 |
| C、SO2的催化氧化是一个放热的反应,所以升高温度,V逆加快,V正减慢 |
| D、对于CaCO3+2HCl═CaCl2+H2O+CO2↑不能用CaCO3的浓度变化来表示反应速率,但可用水的浓度变化来表示 |
下列反应中氯元素全部被还原的是( )
| A、MnO2+4HCl=MnCl2+2H2O+Cl2↑ | ||||
| B、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O | ||||
| C、5Cl2+I2+6H2O=10HCl+2HIO3 | ||||
D、2NaCl+2H2O
|