题目内容
19.短期元素X、Y、Z在周期表中的位置如图所示,则下列说法正确的是( )
| A. | X、Y、Z中Z的单质最稳定 | B. | Y的氢化物为H2Y | ||
| C. | H2Z能发生反应:Cl2+H2Z=Z+2HCl | D. | Y有含氧酸为HYO |
分析 由短周期元素相对位置,可知X为He、Y为F、Z为S.
A.稀有气体的性质最稳定;
B.氟元素氢化物为HF;
C.氯气具有强氧化性,能与硫化氢反应生成S与HCl;
D.氟元素没有含氧酸HFO.
解答 解:由短周期元素相对位置,可知X为He、Y为F、Z为S.
A.稀有气体He最稳定,故A错误;
B.氟元素氢化物为HF,故B错误;
C.氯气具有强氧化性,能与硫化氢反应生成S与HCl,反应方程式为:Cl2+H2S=S+2HCl,故C正确;
D.氟元素没有含氧酸HFO,故D错误.
故选:C.
点评 本题考查元素周期表与元素化合物性质,比较基础,熟练掌握元素周期律表结构,注意对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列叙述不正确的是( )
| A. | H2S与SO2、NO与O2、NH3与HCl在常温下均不能大量共存 | |
| B. | (NH4)2SO3、Ca(HCO3)2、NaAlO2均既能和稀硫酸又能和氢氧化钠溶液反应 | |
| C. | Fe(OH)3、FeCl2、FeCl3均可通过化合反应得到 | |
| D. | 制备Fe(OH)2时加苯液封,同时将滴管插入苯层液面以下,其目的是防止Fe(OH)2被空气氧化 |
10.如图是氢氧燃料电池结构示意图,下列关于该电池的说法中,正确的是( )
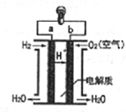

| A. | b极是负极 | B. | 正极发生氧化反应 | ||
| C. | a极的电极反应是H2-2e-=2H+ | D. | 该电池工作时,有淡蓝色火焰产生 |
7.下列有关化学反应原理的分析错误的是( )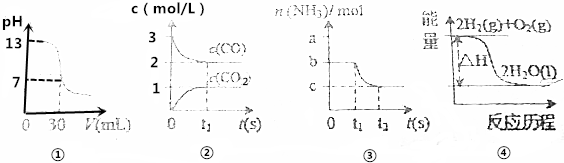
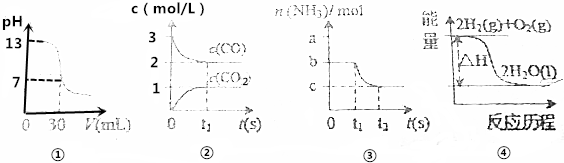
| A. | 图①表示25℃时,0.1000mol•L-1某一元酸滴定25.00mL 0.1000mol•L-1NaOH溶液,则根据图中数据可以计算出该温度下该一元酸的电离常数Ka | |
| B. | 图②表示某温度下的反应2CO(g)?C(s)+CO2(g)中的气体浓度随时间变化的曲线,则根据图中数据可计算该温度下的平衡常数K | |
| C. | 图③表示N2(g)+3H2(g)?2NH3(g)的平衡移动曲线,t1时刻改变的条件可能是降低压强 | |
| D. | 图④表示的反应热△H,可根据H2、O2、H2O的共价键的键能计算 |
14.下列各组物质的晶体中,化学键类型完全相同、晶体类型也相同的是( )
| A. | CO2和SiO2 | B. | NaCl和HCl | C. | H2O和H2 | D. | KOH和KCl |
4.含硒(Se)的保健品已开始进入市场.已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是( )
| A. | 非金属性比硫强 | B. | 阴离子比Br-半径小 | ||
| C. | 原子序数为34 | D. | 最高价氧化物的水化物显碱性 |
8.用下列方法制取氢气,反应速率最大的是( )
| A. | 30℃,块状锌与2 mol•L一1硫酸溶液反应 | |
| B. | 30℃,粉末状铁与2 mol•L一1硫酸溶液反应 | |
| C. | 60℃,粉末状锌与2 mol•L一1硫酸溶液反应 | |
| D. | 60℃,粉末状镁与2mol•L一1硫酸溶液反应 |

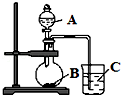 某研究性学习小组设计了一组实验,验证元素周期律.
某研究性学习小组设计了一组实验,验证元素周期律.