题目内容
10.饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.(1)砷与磷为同一主族元素,磷的原子结构示意图为
 .
.(2)根据元素周期律,下列说法正确的是ac.
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+.
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
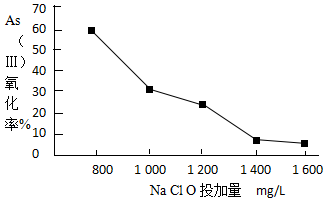
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低.
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.
已知:一定条件下,As(Ⅴ)的存在形式如表所示:
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 | H2AsO3- | HAsO42- | HAsO42-、AsO43- |
分析 (1)磷原子核外电子数为15,有3个电子层,由里到外各层电子数为2、8、5;
(2)a.同周期自左而右非金属性增强,最高价氧化物对应水化物酸性增强,同主族自上而下非金属性减弱,最高价氧化物对应水化物酸性减弱;
b.同周期自左而右原子半径减小,同主族自上而下原子半径依次增大;
c.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:S>P>As,故c正确;
故答案为:ac;
(3)FeS2水溶液中被O2氧化生成硫酸、氢氧化铁;
(4)图象中曲线变化和溶液浓度越大盐水解程度越小分析;
(5)pH=6时,NaClO溶液中生成HClO,图中分析可知pH=6时As(Ⅴ)的存在形式为H2AsO4-.
解答 解:(1)磷原子核外电子数为15,有3个电子层,由里到外各层电子数为2、8、5,磷原子结构示意图为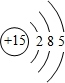 ,故答案为:
,故答案为: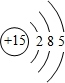 ;
;
(2)a.同周期自左而右非金属性增强,最高价氧化物对应水化物酸性增强,同主族自上而下非金属性减弱,最高价氧化物对应水化物酸性减弱,酸性:H2SO4>H3PO4>H3AsO4,故a正确;
b.同周期自左而右原子半径减小,同主族自上而下原子半径依次增大,原子半径:As>P>S,故b错误;
c.同周期自左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:S>P>As,故c正确;
故答案为:a c;
(3)FeS2水溶液中被O2氧化生成硫酸、氢氧化铁,反应的化学方程式为:4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+,
故答案为:4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+;
(4)投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是:起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低,
故答案为:起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低;
(5)pH=6时,NaClO溶液中生成HClO,pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是:HClO+H3AsO3 =H2AsO4-+Cl-+2H+,
故答案为:HClO+H3AsO3 =H2AsO4-+Cl-+2H+.
点评 本题考查了原子结构、周期表变化规律、化学方程式和离子方程式书写、数据和图象分析方法,掌握基础是解题关键,题目难度中等.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案| A. | 酸雨易导致土壤胶粒吸附H+使土壤酸化,影响铵态氮肥和钾肥的有效利用 | |
| B. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| C. | 高纯度的单晶硅用于制造登月车的光电池和光导纤维 | |
| D. | 铝及其合金是电气、工业、家庭广泛使用的材料,通常用电解氯化铝的方法制取铝 |
已知:
S2O82-+2I-═2SO42-+I2(慢)
I2+2S2O32-═2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O82-):n(S2O32-)$>\frac{1}{2}$.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
| 实验 序号 | 体积V/ml | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
(3)已知:2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是生成的锰离子有催化作用的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是C.
A.硫酸钾 B.氯化锰 C.硫酸锰 D.水.
| 选项 | 实验 | 现象 | 结论或解释 |
| A | 将0.1mol•L-1MgSO4溶液滴入 过量NaOH溶液,再滴加几滴0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成,后有蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化但不滴落下来 | 铝箔表面有致密Al2O3薄膜,Al2O3且熔点高于Al |
| C | 向新收集的酸雨中滴加硝酸钡溶液 | 产生白色沉淀 | 酸雨中一定含有SO42- |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 大气中PM2.5比表面积大,吸附力强,能吸附许多有毒、有害物质 | |
| B. | Na2S具有还原性,作废水中Cu2+、Hg2+沉淀剂 | |
| C. | 石墨烯一种由单层碳原子构成的新纳米材料,具有导电性 | |
| D. | 刚玉、红宝石主要或分是氧化铝,陶瓷、分子筛主要成分是硅酸盐 |
| 实验目的 | 实验方案 | |
| A | 检验Na2SO3晶体是否已氧化变质 | 将Na2SO3样品溶于稀硝酸后,滴加BaCl2溶液,观察是否有沉淀生成 |
| B | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| C | 制备氢氧化铁胶体 | 向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色 |
| D | 证明Mg(OH)2沉淀可转化为Fe(OH)3沉淀 | 向2mL 1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 原电池的正极和电解池阳极 | B. | 电解池阳极和电解池阴极 | ||
| C. | 原电池负极和电解池阳极 | D. | 原电池的正极和原电池负极 |