题目内容
1.参考图甲、图乙和有关要求回答问题:(1)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2.图丙是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是减小 (填“增大”、“减小”、“不变”),反应热△H的变化是不变(填“增大”、“减小”、“不变”).请写出CH3OH(g)和H2O(g)反应的热化学方程式CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol.
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的另一种反应原理是:
CH3OH(g)+$\frac{1}{2}$O2(g)?CO2(g)+2H2(g)△H=c kJ/mol; H2O(g)?H2O(l)△H=d kJ/mol.
则甲醇燃烧生成液态水的热化学方程式为2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-(4a-4b-6c-4d)kJ/mol.
(3)以CH3OH燃料电池为电源电解法制取ClO2.二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
①CH3OH燃料电池放电过程中,通入O2的电极附近溶液的pH增大,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O.
②图中电解池用石墨作电极,在一定条件下电解饱和食盐水制取 ClO2.阳极产生 ClO2的反应式为Cl--5e-+2H2O=4H++ClO2↑.
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),停止电解,通过阳离子交换膜的阳离子为1mol.

分析 (1)催化剂能降低反应的活化能,加快反应速率,但催化剂不能改变化学平衡,根据图象求算△H,根据热化学方程式的书写方法书写CH3OH(g)和H2O(g)反应的热化学方程式;
(2)根据已知方程式①×6+②×4-③×4构建目标方程式,根据盖斯定律计算反应热,根据热化学方程式的书写方法书写CH3OH(g)、O2(g)反应的热化学方程式;
(3)以CH3OH燃料电池为电源电解法制取ClO2.二氧化氯(ClO2)为一种黄绿色气体,通入O2的电极是正极,负极甲醇失去电子在碱溶液中生成碳酸盐,
①CH3OH燃料电池放电过程中,通入O2的电极是正极,氧气得到电子转化为氢氧根,则附近溶液的pH增大,负极甲醇失去电子在碱溶液中生成碳酸盐;
②电解池中阳极失去电子,则阳极氯离子放电,产生ClO2,结合电子守恒和电荷守恒配平书写;
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),多出的气体是氢气,设阳极产生的气体是xmol,则根据电子得失守恒计算.
解答 解:(1)催化剂降低反应的活化能,加快反应速率,即a减小,但催化剂不能改变反应热,即反应热△H不变,反应能量图中生成物的总能量大于反应物的总能量,则为吸热反应,由图可知,1mol 甲醇和1mol 水蒸气反应生成CO2和氢气吸收的热量为(a-b)kJ,反应热化学方程式为:CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol,
故答案为:减小;不变;CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol;
(2)已知:①CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=c kJ/mol,
②H2O(g)=H2O(l)△H=d kJ/mol,
③CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+(a-b)kJ/mol,
则根据盖斯定律可知①×6+②×4-③×4即可得到甲醇燃烧生成液态水的热化学方程式为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-(4a-4b-6c-4d)kJ/mol,
故答案为:2CH3OH(g)+3O2(g)=2 CO2(g)+4 H2O(l)△H=-(4a-4b-6c-4d)kJ/mol;
(3)①CH3OH燃料电池放电过程中,通入O2的电极是正极,氧气得到电子转化为氢氧根,则附近溶液的pH增大,负极甲醇失去电子,反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:增大,CH3OH-6e-+8OH-=CO32-+6H2O;
②电解池中阳极失去电子,则阳极氯离子放电,产生ClO2的反应式为:Cl--5e-+2H2O=4H++ClO2↑,
故答案为:Cl--5e-+2H2O=4H++ClO2↑;
③电解一段时间,从阴极处收集到的气体比阳极处收集到气体多 6.72L时(标准状况,忽略生成的气体溶解),多出的气体是氢气,物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,设阳极产生的气体是xmol,则根据电子得失守恒可知5x=(0.3+x)×2,解得x=0.2,即转移1mol电子,钠离子通过阳离子交换膜,所以通过阳离子交换膜的阳离子为1mol,
故答案为:1.
点评 本题主要是考查催化剂对反应速率、反应热的影响、盖斯定律应用及电化学原理的应用,注意原电池和电解池的原理分析和电极反应书写,题目难度中等.

 考前必练系列答案
考前必练系列答案| A. | 氧化铁能与酸反应,可用于制作红色涂料 | |
| B. | SO2具有漂白性,可在白葡萄酒中微量添加 | |
| C. | 钠钾合金硬度小,可用作原子反应堆的导热剂 | |
| D. | 酒精能使蛋白质变性,可在医疗上用来杀菌消毒 |
| A. | 75.77%表示35Cl的质量分数 | |
| B. | 24.23%表示35Cl在自然界所占的原子个数百分比 | |
| C. | 35.453表示氯元素的相对原子质量 | |
| D. | 36.966表示37Cl的质量数 |
| A. | Z的简单气态氢化物的热稳定性比Y的强 | |
| B. | 原子半径:r(W)>r(Q)>r(Z)>r(X) | |
| C. | 由X、Y、Z三种元素组成的化合物可以是酸、碱或盐 | |
| D. | Q的最高于氧化物对应的水化物可以溶于浓的YX4W溶液 |
| A. | 向稀NaOH溶液中通入Cl2:Cl2+2OH-═ClO-+Cl-+H2O | |
| B. | 向Fe2(SO4)3溶液中加入铜粉:2Fe3++3Cu═2Fe+3Cu2+ | |
| C. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 向氨水中通入过量SO2:SO2+OH-═HSO3- |
(1)砷与磷为同一主族元素,磷的原子结构示意图为
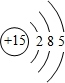 .
.(2)根据元素周期律,下列说法正确的是ac.
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+.
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
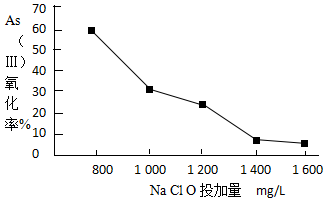
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低.
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.
已知:一定条件下,As(Ⅴ)的存在形式如表所示:
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 | H2AsO3- | HAsO42- | HAsO42-、AsO43- |
| 实验 序号 | 浓度 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为0.02mol/(L•min)
(2)在实验1中,c1数值为0.50
(3)在实验1、2中有一个实验使用了正催化剂.判断是实验2 (选填“1”或“2”)使用了正催化剂.
(4)在实验1、3中反应温度不同.判断T3> 800(选填“<”或“>”).
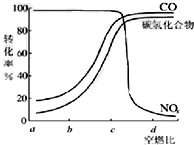 在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.