题目内容
20.在原电池和电解池的电极上所发生反应的类型相同的是( )| A. | 原电池的正极和电解池阳极 | B. | 电解池阳极和电解池阴极 | ||
| C. | 原电池负极和电解池阳极 | D. | 原电池的正极和原电池负极 |
分析 原电池正极和电解池阴极上得电子发生还原反应,原电池负极和电解池阳极上失电子发生氧化反应,以此解答该题.
解答 解:原电池正极和电解池阴极上得电子而发生还原反应,原电池负极和电解池阳极上失电子发生氧化反应,所以原电池负极和电解池阳极上反应类型相同、原电池正极和电解池阴极上反应类型相同,
故选C.
点评 本题考查了原电池和电解池原理,为高频考点,明确正负极和阴阳极上得失电子即可解答,根据反应类型来分析解答,题目难度不大.

练习册系列答案
相关题目
10.饮用水中含有砷会导致砷中毒,水体中溶解的砷主要以As(Ⅲ)亚砷酸盐和As(Ⅴ)砷酸盐形式存在.
(1)砷与磷为同一主族元素,磷的原子结构示意图为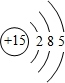 .
.
(2)根据元素周期律,下列说法正确的是ac.
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+.
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:
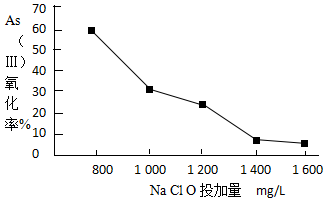
已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低.
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.
已知:一定条件下,As(Ⅴ)的存在形式如表所示:
pH=6时,NaClO氧化亚砷酸(H3AsO3)的离子方程式是HClO+H3AsO3 =H2AsO4-+Cl-+2H+.
(1)砷与磷为同一主族元素,磷的原子结构示意图为
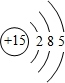 .
.(2)根据元素周期律,下列说法正确的是ac.
a.酸性:H2SO4>H3PO4>H3AsO4
b.原子半径:S>P>As
c.非金属性:S>P>As
(3)关于地下水中砷的来源有多种假设,其中一种认为是富含砷的黄铁矿(FeS2)被氧化为Fe(OH)3,同时生成SO42-,导致砷脱离矿体进入地下水.FeS2被O2氧化的离子方程式为4FeS2+15O2+14H2O=4Fe(OH)3+8SO42-+16H+.
(4)去除水体中的砷,可先将As(Ⅲ)转化为As(Ⅴ),选用NaClO可实现该转化.研究NaClO投加量对As(Ⅲ)氧化率的影响得到如下结果:

已知:投料前水样pH=5.81,0.1mol/LNaClO溶液pH=10.5,溶液中起氧化作用的物质是次氯酸.产生此结果的原因是起氧化作用的物质是次氯酸,NaClO溶液为碱性,当加入量大时,溶液碱性增强,NaClO溶液浓度增大,水解程度降低,次氯酸不易生成,所以As(Ⅲ)氧化率降低.
(5)强阴离子交换柱可以吸附以阴离子形态存在的As(Ⅴ)达到去除As的目的.
已知:一定条件下,As(Ⅴ)的存在形式如表所示:
| pH | <2 | 2~7 | 7~11 | 11~14 |
| 存在形式 | H3AsO4 | H2AsO3- | HAsO42- | HAsO42-、AsO43- |
11.某化学反应2A?B+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如表所示,表中温度为摄氏度(℃).
根据上述数据,回答下列问题:
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为0.02mol/(L•min)
(2)在实验1中,c1数值为0.50
(3)在实验1、2中有一个实验使用了正催化剂.判断是实验2 (选填“1”或“2”)使用了正催化剂.
(4)在实验1、3中反应温度不同.判断T3> 800(选填“<”或“>”).
| 实验 序号 | 浓度 时间 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | c1 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | T3 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)在实验1中,以反应物A浓度的变化表示该反应在0~10min内的平均反应速率为0.02mol/(L•min)
(2)在实验1中,c1数值为0.50
(3)在实验1、2中有一个实验使用了正催化剂.判断是实验2 (选填“1”或“2”)使用了正催化剂.
(4)在实验1、3中反应温度不同.判断T3> 800(选填“<”或“>”).
8.香天竺葵醇具有温和、香甜的玫瑰花气息,其结构式如图所示.下列有关香天竺葵醇的说法错误的是( )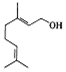

| A. | 分子中含有两种官能团 | |
| B. | lmol该物质与lmolHBr发生加成反应的产物共有5种(不考虑立体异构) | |
| C. | 使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理不同 | |
| D. | 香天竺葵醇能发生加聚反应和氧化反应 |
15.化学电池的反应本质上属于( )
| A. | 氧化还原反应 | B. | 分解反应 | C. | 化合反应 | D. | 复分解反应 |
5.某元素原子最外层只有1个电子,它与卤素相结合时,所形成的化学键( )
| A. | 一定是共价键 | B. | 一定是离子健 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 既含离子键又含共价键 |
12.药物阿司匹林可由水杨酸制得,它们的结构如图所示.下列有关说法正确的是( )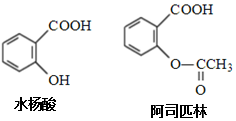

| A. | 阿司匹林分子中存在碳碳双键和碳氧双键 | |
| B. | 阿司匹林的分子式为C9H10O4,能与NaHCO3反应 | |
| C. | 水杨酸可以发生取代反应和加成反应 | |
| D. | 水杨酸的同分异构体中,含有羧基和羟基的只有2种 |
9.某有机物X的结构简式如图所示,则下列说法正确的是( )
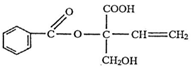

| A. | X的分子式为C12H14O5 | |
| B. | 1molX最多消耗1molNaOH | |
| C. | X在一定条件下能发生取代、加成、加聚、氧化等反应 | |
| D. | X苯环上的二氯代物有7种(不考虑立体异构) |
5.下列有关说法正确的是( )
| A. | 常温下,PH均为9的CH3COONa和NaOH溶液中,水的电离程度不相同 | |
| B. | 反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H>0 | |
| C. | 向浓度均为0.1 mol•L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,说明Ksp[Mg(OH)2]>Ksp[Cu(OH)2] | |
| D. | 已知I${\;}_{3}^{-}$?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |